摘要:(3)NHNH3↑+CO
网址:http://m.1010jiajiao.com/timu_id_3938[举报]
 (2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.(1)上述四种气体中直接排入空气时会引起酸雨的有
NO、NO2、SO2
NO、NO2、SO2
(填化学式).(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1;
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1.
①反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol-1.②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是
ad
ad
(填字母).a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示.
①上述合成甲醇的反应为
放热
放热
(填“放热”或“吸热”)反应.②A、B、C三点的平衡常数KA、KB、KC的大小关系为
KA=KB>KC
KA=KB>KC
.③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
2
2
L.(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向
b
b
(填“a”或“b”)极移动.②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为
2CH3OH+3O2+4OH-=2CO32-+6H2O;
2CH3OH+3O2+4OH-=2CO32-+6H2O;
.
研究物质的微观结构,有助于人们理解物质性质和变化的本质.请回答下列问题.
(1)CH4中H为+1价,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序是: .
(2)A、B均为短周期金属元素.依据下表数据和已学知识,写出B原子的电子排布式: .
(3)CO与Cl2在催化剂作用下生成COCl2,COCl2俗称光气,极毒,光气分子呈平面三角形,结构式为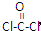 ,COCl2分子内含有 (填标号)
,COCl2分子内含有 (填标号)
A.4个σ键 B.2个σ键、2个π键
C.3个σ键、1个π键 D.2个σ键、1个π键. 查看习题详情和答案>>
(1)CH4中H为+1价,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序是:
(2)A、B均为短周期金属元素.依据下表数据和已学知识,写出B原子的电子排布式:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
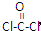 ,COCl2分子内含有
,COCl2分子内含有A.4个σ键 B.2个σ键、2个π键
C.3个σ键、1个π键 D.2个σ键、1个π键. 查看习题详情和答案>>
溶液中可能有下列阴离子中的一种或几种:SO
、S0
、CO
、Cl-.
(1)当溶液中有大量H+存在时,则不可能有
(2)当溶液中有大量Ba2+存在时,溶液中不可能有
(3)当溶液中有
查看习题详情和答案>>
2- 4 |
2- 3 |
2- 3 |
(1)当溶液中有大量H+存在时,则不可能有
SO32-、CO32-
SO32-、CO32-
存在.(2)当溶液中有大量Ba2+存在时,溶液中不可能有
SO42-、SO32-、CO32-
SO42-、SO32-、CO32-
存在.(3)当溶液中有
Ba2+
Ba2+
和Ag+
Ag+
的阳离子存在时,上述所有阴离子都不可能存在.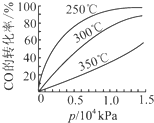 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用水吸收,相应的化学反应方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.利用反应6NO2+8NH3| 催化剂 |
| 加热 |
6.72
6.72
L.(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol-1.一定条件下,将NO2与SO2以物质的量比1:2置于密闭容器中发生上述反应,当反应达到平衡状态时,测得NO2与SO2物质的量比为1:6,则平衡常数K=
| 8 |
| 3 |
| 8 |
| 3 |
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H
<
<
0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
.