网址:http://m.1010jiajiao.com/timu_id_3924[举报]
![]() +
+![]() +H+
+H+![]() CO2↑+Mn2++H2O;
CO2↑+Mn2++H2O;![]() +Fe2++H+
+Fe2++H+![]() Fe3++Mn2++H2O。
Fe3++Mn2++H2O。
现称取草酸亚铁(FeC2O4)样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol·L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1)试分别配平下列两个离子反应式。
□![]() +□
+□![]() +□H+
+□H+![]() □CO2↑+□Mn2++□H2O;
□CO2↑+□Mn2++□H2O;
□![]() +□Fe2++□H+
+□Fe2++□H+![]() □Fe3++□Mn2++□H2O。
□Fe3++□Mn2++□H2O。
(2)求样品中草酸亚铁的质量分数。
查看习题详情和答案>>已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO4- + C2O42- + H+ → CO2↑+ Mn2+ + H2O
现称取草酸亚铁[FeC2O4]样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol?L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1) 请写出MnO4-和Fe2+反应的离子方程式(反应物与生成物分别填入以下空格内)。
MnO4- + Fe2+ + → + + 。
(2)反应中,被还原的元素是 ,还原剂是 。
(3)将高锰酸钾氧化 C2O42- 反应中的氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
![]()
(4)求样品中草酸亚铁的质量分数
查看习题详情和答案>>已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,
则下列有关说法中不正确的是

A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
查看习题详情和答案>>
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,
则下列有关说法中不正确的是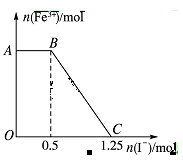
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
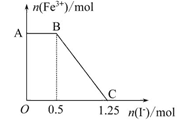
则下列有关说法不正确的是( )
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |