摘要:解得:n(C2H6)=n(C2H4)=0.5 mol.=2 mol, n(CO)+n(CO2)=2 mol 故n(O2)=3 mol,
网址:http://m.1010jiajiao.com/timu_id_3947[举报]
(2012?长宁区二模)在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,以除去这些废气,其主要反应为:2NO2+2NaOH→NaNO2+NaNO3+H2O,NO+NO2+2NaOH→2NaNO2+H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2 和 NaNO3物质的量各为多少?
(2)NO和NO2的混合气体的组成可表示为NOX,该混合气体通入NaOH溶液被完全吸收时,x的值可以为
a.1.1 b.1.2 c.1.5 d.1.8
若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2.
(3)请写出纯碱溶液吸收NO2的化学方程式
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:
≥
≥
;该Na2CO3溶液的物质的量浓度为
mol/L(用含a、b的代数式表示).
(5)若在标准状况下,2.016L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为
查看习题详情和答案>>
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2 和 NaNO3物质的量各为多少?
(2)NO和NO2的混合气体的组成可表示为NOX,该混合气体通入NaOH溶液被完全吸收时,x的值可以为
cd
cd
(填编号).a.1.1 b.1.2 c.1.5 d.1.8
若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2.
(3)请写出纯碱溶液吸收NO2的化学方程式
2NO2+Na2CO3=NaNO2+NaNO3+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
.(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:
| a |
| b |
| 5 |
| 6 |
| a |
| b |
| 5 |
| 6 |
| 1.2a +b |
| 8.96 |
| 1.2a +b |
| 8.96 |
(5)若在标准状况下,2.016L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为
1:5
1:5
.写出本小题的计算过程:设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,x+y+z=
=0.09
2x+y+3z=
×4 (得失电子守恒)
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
| 2.016 |
| 22.4 |
2x+y+3z=
| 0.896 |
| 22.4 |
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,x+y+z=
=0.09
2x+y+3z=
×4 (得失电子守恒)
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
.| 2.016 |
| 22.4 |
2x+y+3z=
| 0.896 |
| 22.4 |
2 x+y+z=0.05×2 (氮原子子守恒、钠离子守恒)
解得:x=0.01(mol),y=0.05(mol),z=0.03(mol)
∴V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5.
 (2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.
(2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.(1)用如图所示装置制取NO,验证U型管中生成的气体是NO的实验方法是
打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO
打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO
.(2)将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032mol.将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O.
①计算空气中参加反应的O2在标准状况下的体积为
112
112
mL.②计算0.009mol 混合气体中N2O4的物质的量(写出计算过程)
设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
.x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
根据烷烃、烯烃、炔烃燃烧的反应式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2);对于烯烃有n(H2O)-n(CO2)=0;对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)C2H6和C2H4的混合气体1.0L在氧气中充分燃烧后生成2.0LCO2和2.4L水蒸气(相同状况下),则混合气体中C2H6与C2H4的体积之比是_____________(填序号)。
A.3∶1 B.1∶3 C.2∶3 D.3∶2
(2)某混合气体由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0L混合气体在氧气中充分燃烧,产生3.0LCO2和3.7L水蒸气(相同状况下)。
①判断混合气体由___________和__________两类烃组成。
②上述判断的理由是____________。
③上述两类烃的体积之比为________。 查看习题详情和答案>>
(1)C2H6和C2H4的混合气体1.0L在氧气中充分燃烧后生成2.0LCO2和2.4L水蒸气(相同状况下),则混合气体中C2H6与C2H4的体积之比是_____________(填序号)。
A.3∶1 B.1∶3 C.2∶3 D.3∶2
(2)某混合气体由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0L混合气体在氧气中充分燃烧,产生3.0LCO2和3.7L水蒸气(相同状况下)。
①判断混合气体由___________和__________两类烃组成。
②上述判断的理由是____________。
③上述两类烃的体积之比为________。 查看习题详情和答案>>
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有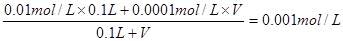 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此 ,解得V=0.0818L。
,解得V=0.0818L。
查看习题详情和答案>>
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此![]() ,解得V=0.0818L。
,解得V=0.0818L。
查看习题详情和答案>>