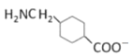
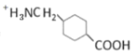
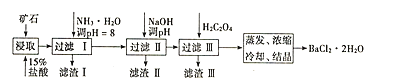
【题目】某矿石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用该矿石制备BaCl22H2O的流程如图,且三次滤渣的主要成分各不相同:
如表为常温时各离子转化为氢氧化物沉淀时的pH:
Fe3+ | Mg2+ | Ca2+ | |
开始沉淀时的pH | 1.9 | 9.1 | 11.9 |
完全沉淀时的pH | 3.2 | 11.1 | 13.9 |
(1)用15%盐酸浸取前需充分研磨,目的是______。
(2)滤渣Ⅰ的主要成分为______;加入NaOH调pH的范围为______;加入H2C2O4时应避免过量的原因是______。[已知难溶物质:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式______,该反应的平衡常数K=______。
(4)取制得的BaCl22H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高锰酸钾标准液的仪器为______,滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色______,即说明达到滴定终点。
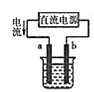
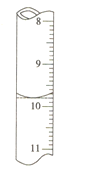
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl22H2O的纯度为______(保留3位有效数字)。
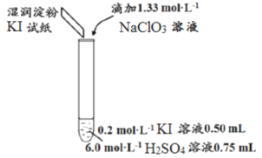
【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
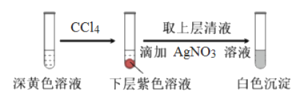
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
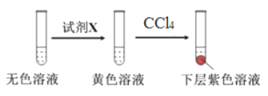
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。
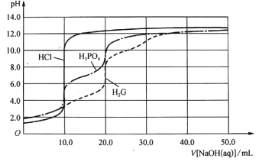
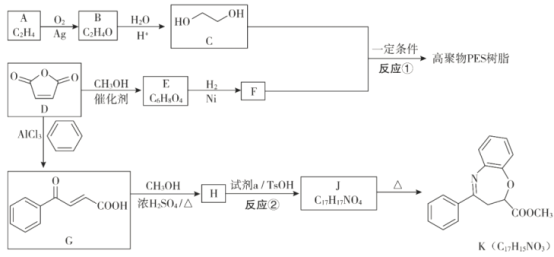
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)已知:CH4(g)+H2O(g)CO(g)+3H2(g) H=+206.0kJ/mol-1
CH4(g)+H2O(g)CH3OH(g)+H2(g) H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是______________________。
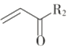
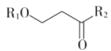
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
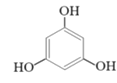 +2CH3OH
+2CH3OH![]()
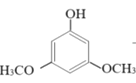 +2H2O
+2H2O
反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是______________________(填字母序号)。
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是______________________(填字母序号)。
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
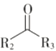
(3)甲醇可用于实验室制备丙炔酸甲酯(CH![]() C—COOCH3,沸点为103~105℃)。
C—COOCH3,沸点为103~105℃)。
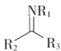
反应为:CH≡C—COOH+CH3OH![]() CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是______________,蒸馏烧瓶中加入碎瓷片的目的是_______________。
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是______________________;分离出有机相的操作名称为_____________________。
③步骤4中,蒸馏时不能用水浴加热的原因是______________________。