题目内容
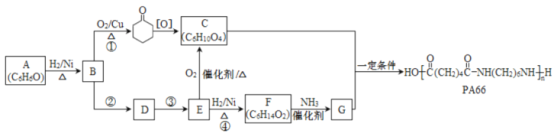
【题目】某矿石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用该矿石制备BaCl22H2O的流程如图,且三次滤渣的主要成分各不相同:
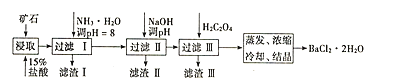
如表为常温时各离子转化为氢氧化物沉淀时的pH:
Fe3+ | Mg2+ | Ca2+ | |
开始沉淀时的pH | 1.9 | 9.1 | 11.9 |
完全沉淀时的pH | 3.2 | 11.1 | 13.9 |
(1)用15%盐酸浸取前需充分研磨,目的是______。
(2)滤渣Ⅰ的主要成分为______;加入NaOH调pH的范围为______;加入H2C2O4时应避免过量的原因是______。[已知难溶物质:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式______,该反应的平衡常数K=______。
(4)取制得的BaCl22H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高锰酸钾标准液的仪器为______,滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色______,即说明达到滴定终点。
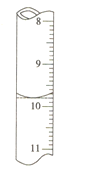
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl22H2O的纯度为______(保留3位有效数字)。
【答案】增大接触面积,使反应速率加快 Fe(OH)3 11.1<pH<11.9 H2C2O4过量会导致生成BaC2O4沉淀,BaCl22H2O的产量减少 CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq) 0.5 酸式滴定管 由无色变为红色,且半分钟不褪色 97.6%
【解析】
制备BaCl22H2O的流程:矿石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调节pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣Ⅰ为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,因此Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到滤渣ⅢCaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O,据此分析解答。
(1)化学反应的速率与反应物的接触面积有关,矿石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,故答案为:增大接触面积,使反应速率加快;
(2)根据上述Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣I为Fe(OH)3,若要除去Mg2+和Fe3+,则需要使Fe3+和Mg2+完全形成沉淀,但同时不能沉淀Ca2+,根据表中数据分析,应调节pH范围在11.1<pH<11.9;溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,使产品的产量减少,故答案为:Fe(OH)3;11.1<pH<11.9;H2C2O4过量会导致生成BaC2O4沉淀,BaCl22H2O的产量减少;
(3)向有CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,发生沉淀的转化,由CaCO3转化为BaCO3,则反应的离子方程式为CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq),该反应的化学平衡常数为K=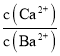 =
= =
=![]() =0.5,故答案为:CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq);0.5;
=0.5,故答案为:CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq);0.5;
(4)①高锰酸钾溶液具有氧化性,只能盛放在酸式滴定管中;高锰酸根离子被还原生成的锰离子为无色,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色由无色变为红色,且半分钟不褪色,说明达到滴定终点,故答案为:酸式滴定管;由无色变为红色,且半分钟不褪色;
②滴定管示数从上到下示数不断增大,根据图示,滴定管读数为9.80mL,消耗KMnO4溶液体积为8.00mL,设BaCl22H2O的纯度为α,
5BaCl22H2O~5H2C2O4~2KMnO4
5×244g 2mol
2.5gα 0.05mol/L×8×10-3×![]() L
L
![]() =
=![]() ,解得:α=97.6%,故答案为:97.6%。
,解得:α=97.6%,故答案为:97.6%。

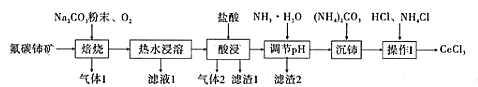
【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。