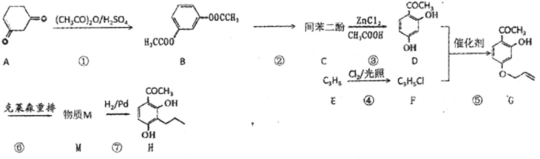
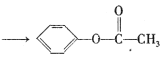
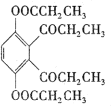
题目内容
【题目】关于室温下pH=2的盐酸和0.01molL-1的醋酸溶液,下列说法正确的是( )
A.两溶液中溶质的物质的量:n(CH3COOH)=n(HCl)
B.两溶液中阴离子的浓度:c(CH3COO-)<c(Cl-)
C.相同体积的两溶液均用水稀释100倍后,盐酸的pH比醋酸的大
D.相同体积的两溶液分别与足量镁条反应,盐酸产生的气体比醋酸的多
【答案】B
【解析】
pH=2的盐酸和0.01molL-1的醋酸溶液的浓度均为0.01mol/L,即两种酸的浓度相等。
A.两种酸的浓度相等,即c(CH3COOH)=c(HCl),由n=cV可知,两种酸的体积V相同时n(CH3COOH)=n(HCl),但两酸的体积V不确定,所以不能判断两溶液中溶质的物质的量的大小关系,故A错误;
B.两种酸的浓度相等,但醋酸是弱酸、部分电离,所以两溶液中阴离子的浓度:c(CH3COO-)<c(Cl-),故B正确;
C.相同体积的两溶液均用水稀释100倍后,两种酸的浓度仍然相等,但醋酸是弱酸、部分电离,所以醋酸的酸性弱、pH大,故C错误;
D.两种酸的浓度相等、体积相等,则酸的物质的量:n(CH3COOH)=n(HCl),与足量Mg反应时n(H2)=![]() n(CH3COOH)=
n(CH3COOH)=![]() n(HCl),所以生成氢气体积相等,故D错误;
n(HCl),所以生成氢气体积相等,故D错误;
故选B。

练习册系列答案
相关题目