题目内容
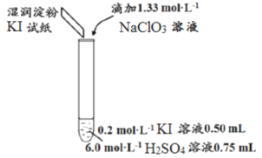
【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
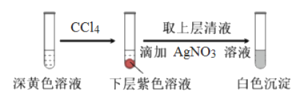
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
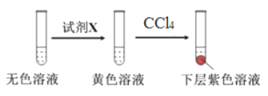
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。
【答案】ClO3-+6I-+6H+=Cl-+3I2+3H2O 2ClO3-+I2=Cl2↑+2IO3- c H+(或H2SO4)的用量少时,ClO3-和I-的反应生成I2,H+(或H2SO4)的用量多时,ClO3-和I-的反应生成IO3-。 6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O
【解析】
实验1中,无色NaClO3用量少,试管中溶液呈浅黄色,KI试纸为无色,则表明试管中生成I2,但没有Cl2生成。实验2中,无色NaClO3用量增多,试管中溶液呈深黄色,KI试纸为无色,则表明试管中生成I2的量增多,但仍没有Cl2生成。实验3中,继续增加NaClO3用量,试管中溶液呈浅黄色,KI试纸为蓝色,则表明试管中生成I2的量不多,但有Cl2生成。
实验4中,继续增加NaClO3用量,试管中溶液呈无色,KI试纸为蓝色,则表明试管中生成I2又被氧化为IO3-,但有Cl2生成。
(1)从实验现象看,加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应,生成I2和Cl-等。离子方程式ClO3-+6I-+6H+=Cl-+3I2+3H2O。答案为:ClO3-+6I-+6H+=Cl-+3I2+3H2O;
(2)NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物I2继续反应,生成IO3-,同时生成Cl2,反应的离子方程式是2ClO3-+I2=Cl2↑+2IO3-。答案为:2ClO3-+I2=Cl2↑+2IO3-;
取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X应具有还原性,可将IO3-还原为I2,所以X可以是NaHSO3溶液,故选c。答案为:c;
(3)①实验5是在实验4的基础上减少硫酸的用量,溶液由无色变为浅黄色,试纸由蓝色变为无色,则表明有I2生成但不生成Cl2,可以获得的结论是H+(或H2SO4)的用量少时,ClO3-和I-的反应生成I2,H+(或H2SO4)的用量多时,ClO3-和I-的反应生成IO3-。答案为:H+(或H2SO4)的用量少时,ClO3-和I-的反应生成I2,H+(或H2SO4)的用量多时,ClO3-和I-的反应生成IO3-;
②实验6中,增加硫酸用量,溶液无色,试纸变蓝,则表明ClO3-和I-反应,最终生成Cl2和IO3-,离子方程式是6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O。答案为6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】工业上用草酸“沉钴”,再过滤草酸钴得到的母液A经分析主要含有下列成分:
H2C2O4 | Co2+ | Cl- | |
质量浓度 | 20.0g/L | 1.18g/L | 2.13g/L |
为了有效除去母液A中残留的大量草酸,一般用氯气氧化处理草酸,装置如下:
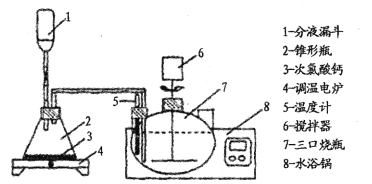
回答下列问题:
(1)母液A中c(CoO2)为____mol·L-1。 ,
(2)分液漏斗中装入盐酸,写出制取氯气的离子方程式 ____________。反应后期使用调温电炉加热,当锥形瓶中____(填现象)时停止加热。
(3)三颈烧瓶反应温度为50℃,水浴锅的温度应控制为 ____(填序号)。
A.50℃ B.5l-52℃ C.45 - 55℃ D.60℃
(4)氯气氧化草酸的化学方程式为________ 。
(5)搅拌器能加快草酸的去除速率,若搅拌速率过快则草酸去除率反而降低,主要原因是__________。
(6)若用草酸铵代替草酸“沉钴”,其优点是____ ,其主要缺点为________。
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
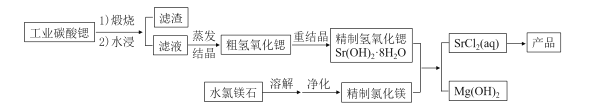
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)已知:CH4(g)+H2O(g)CO(g)+3H2(g) H=+206.0kJ/mol-1
CH4(g)+H2O(g)CH3OH(g)+H2(g) H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是______________________。
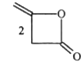
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
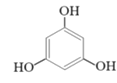 +2CH3OH
+2CH3OH![]()
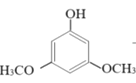 +2H2O
+2H2O
反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是______________________(填字母序号)。
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是______________________(填字母序号)。
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
(3)甲醇可用于实验室制备丙炔酸甲酯(CH![]() C—COOCH3,沸点为103~105℃)。
C—COOCH3,沸点为103~105℃)。
反应为:CH≡C—COOH+CH3OH![]() CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是______________,蒸馏烧瓶中加入碎瓷片的目的是_______________。
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是______________________;分离出有机相的操作名称为_____________________。
③步骤4中,蒸馏时不能用水浴加热的原因是______________________。
【题目】1-溴丁烷是无色透明液体,可用作制药、染料、功能性色素、香料等的原料,也可作半导体中间原料。其实验窒制备原理及流程如图:
KBr+H2SO4![]() HBr+KHSO4
HBr+KHSO4
C4H9OH+HBr![]() C4H9Br+H2O
C4H9Br+H2O

可能用到的有关数据及信息如下表:
名称 | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | 浓硫酸中溶解性 |
正丁醇 | 74 | 117.7 | 0.8098 | 微溶 | 能溶 |
1-溴丁烷 | 137 | 101.6 | 1.266 | 微溶 | 不溶 |
正丁醚 | 130 | 142 | 0.7689 | 不溶 | 反应成盐 |
回答下列问题:
(1)操作Ⅰ是用如图所示实验装置,加热仪器A中的反应物制备1-溴丁烷(加热和夹持装置均略去)。

①仪器B的作用是_________。
②若浓硫酸太浓或加热A时温度过高,均会产生大量红棕色气体,原因是________(用化学方程式表示);该制备反应中产生的有机副产物除正丁醚外,还可能有_______(填结构简式)。
③图中装置有一处错误,请提出改进建议:__________。
(2)操作Ⅱ是用如图所示实验装置蒸出1-溴丁烷粗产品(加热和夹持装置均略去)。

①仪器D的名称是_______。
②判断1-溴丁烷是否蒸完的方法是_______。
(3)操作Ⅲ是将产品转移至分液漏斗中,依次经过水、浓硫酸、水、10mL 10%碳酸钠溶液、水五次洗涤并分液,目的是除去1-溴丁烷粗产品的各种杂质。
①浓硫酸的主要作用是_______。
②用10mL 10%碳酸钠溶液洗涤时必须的操作是_______。
(4)操作N将产品用无水CaCl2干燥后再蒸馏纯化。1-溴丁烷的产率为____ (近似取整)%。