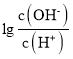题目内容
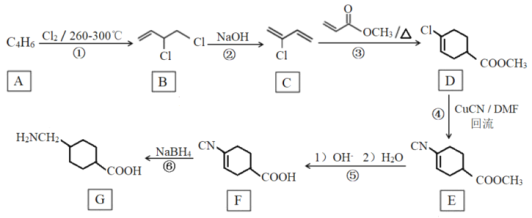
【题目】用0.10 mol/L的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 mol/L的盐酸、磷酸及谷氨酸(H2G),滴定曲线如图所示:
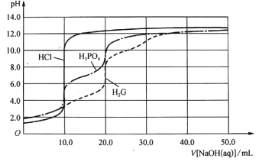
下列说法正确的是
A.滴定盐酸时,用甲基橙作指示剂比用酚酞更好
B.H3PO4与H2G的第一电离平衡常数K1的数量级不同
C.用酚酞作指示剂滴定磷酸到终点时,溶液中的溶质为Na2HPO4
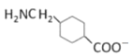
D.NaH2PO4溶液中:![]()
【答案】C
【解析】
A.盐酸和氢氧化钠溶液反应至终点时,pH=7,与酚酞的变色范围8~10接近,甲基橙的变色范围在3.1-4.4,则使用酚酞做指示剂更好,故A错误;
B.滴定前,0.050 mol/L H3PO4与H2G的pH值几乎相等,由此可得,二者第一电离平衡常数Ki的数量级相同,故B错误;
C.20.00mL、0.050 mol/L的磷酸用0.10 mol/L的NaOH完全中和应消耗30mL氢氧化钠,根据图像,滴定磷酸共有两次突跃,第二次为滴定磷酸的终点,用酚酞作指示剂滴定磷酸到终点时,消耗氢氧化钠的体积为20mL,则可以确定达到终点是,溶液中的溶质为Na2HPO4,故C正确,
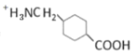
D.当溶液中的溶质为NaH2PO4时,应为磷酸的第一次滴定突跃,根据图像显示,此时溶液显酸性,即H2PO4-的电离程度大于水解程度,即c(HPO42-)>c(H3PO4),则![]() ,故D错误;
,故D错误;
答案选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目