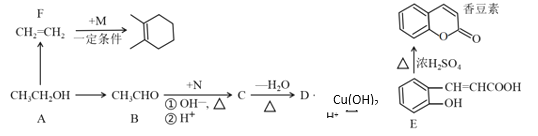
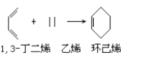
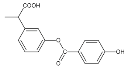
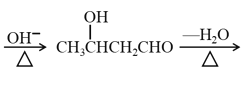【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常数(Ksp)的表达式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。试用沉淀溶解平衡理论解释。____________。
(3)常温下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液调整溶液的pH为多少?(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)_____________。
(4)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,应如何除去?_________。
【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
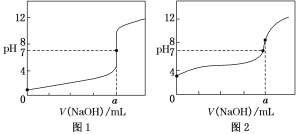
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)