题目内容
【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
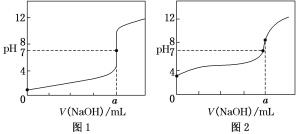
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)
【答案】![]() 1000:1 碱性 9:11 图2 20.00mL 酚酞或甲基橙 偏高
1000:1 碱性 9:11 图2 20.00mL 酚酞或甲基橙 偏高
【解析】
(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中钠离子浓度是1×10-3mol/L,如果稀释10倍,则钠离子浓度是1×10-4mol/L,但硫酸钠溶液是显中性,溶液中c(OH-)是1×10-7mol/L;
(3)根据表中数据可知,在t2温度下,溶液pH=6时,溶液显中性,若pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合所得混合液pH=2,反应后溶液中氢离子的浓度是0.01mol/L;
(4)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1;
②当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,溶液pH=7;
(5)0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用酚酞或甲基橙对实验结果影响不大;若装标准液的滴定管未润洗,标准溶液浓度会减小,消耗标准溶液体积偏大。
(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大,所以若25℃<t1<t2,故答案为:>;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中钠离子浓度是1×10-3mol/L,如果稀释10倍,则钠离子浓度是1×10-4mol/L,硫酸钠溶液是显中性的,则c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1;
(3)根据表中数据可知,在t2温度下,溶液pH=6时,溶液显中性,在t2温度下测得某溶液pH=7,该溶液显碱性;若pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合所得混合液pH=2,反应后溶液中氢离子的浓度是0.01mol/L,则![]() =0.01,,解得a∶b=9∶11,故答案为:碱性;9:11;
=0.01,,解得a∶b=9∶11,故答案为:碱性;9:11;
(4)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,滴定醋酸的曲线是图2,故答案为:图2;
②当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,溶液pH=7,由图可知0.1 mol·L-1的NaOH溶液滴定20.00 mL0.1 mol·L-1的HCl溶液时,a点溶液pH=7,则氢氧化钠溶液的体积为20.00 mL,即a=20.00 mL,故答案为:20.00 mL;
(5)0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用酚酞或甲基橙对实验结果影响不大,选用酚酞或甲基橙都可以;若装标准液的滴定管未润洗,标准溶液浓度会减小,消耗标准溶液体积偏大,导致测定结果偏高,故答案为:酚酞或甲基橙;偏高。