题目内容
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能________B(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为________(用元素符号表示)。
(2)D元素原子的价电子排布式是________。
(3)C元素的电子排布图为________________;E3+的离子符号为________________。
(4)F元素位于元素周期表的________区,其基态原子的电子排布式为________________。
(5)G元素可能的性质________。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
【答案】> N<O<F 3S2 ![]() Fe3+ ds 【Ar】3d104s1 A
Fe3+ ds 【Ar】3d104s1 A
【解析】
由A元素的价电子构型为nsnnpn+1可知n=2,则A为N元素;C元素为最活泼的非金属元素,则C为F元素;由原子序数依次增大可知B为O元素;由D元素核外有三个电子层,最外层电子数是核外电子总数的![]() 可知核外电子总数为12,则D为Mg元素;由E元素正三价离子的3d轨道为半充满状态可知原子序数为26,则E为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则F为Cu元素,G元素与A元素位于同一主族,其某种氧化物有剧毒,为As元素。
可知核外电子总数为12,则D为Mg元素;由E元素正三价离子的3d轨道为半充满状态可知原子序数为26,则E为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则F为Cu元素,G元素与A元素位于同一主族,其某种氧化物有剧毒,为As元素。
(1)同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能降低,N原子最外层为半充满状态,性质稳定,难以失去电子,第一电离能大于O元素;同周期元素,从左到右元素的电负性逐渐增强,则三种元素电负性由小到大的顺序为N<O<F,故答案为:>;N<O<F;
(2)D为Mg元素,最外层电子数为2,价电子排布式为3s2,故答案为:3s2;
(3)C为F元素,原子序数为9,电子排布图为![]() ;E为Fe元素,则E3+的离子符号为Fe3+,故答案为:
;E为Fe元素,则E3+的离子符号为Fe3+,故答案为:![]() ;Fe3+;
;Fe3+;
(4)F为Cu元素,位于周期表ds区,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:ds;1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)A.G为As元素,与Si位于周期表对角线位置,其单质可作为半导体材料,故A正确;
B.同主族元素,从上到下元素非金属性依次减小,电负性依次减小,则As的电负性比P小,故错误;
C. 同主族元素,从上到下元素非金属性依次减小,最高价氧化物对应的水化物酸性依次减弱,磷酸为中强酸,则As的最高价氧化物对应的水化物是弱酸,故错误;
A正确,故答案为:A。

 阅读快车系列答案
阅读快车系列答案【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
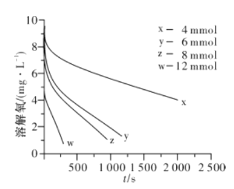
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。