题目内容
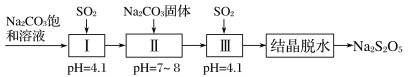
【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常数(Ksp)的表达式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。试用沉淀溶解平衡理论解释。____________。
(3)常温下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液调整溶液的pH为多少?(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)_____________。
(4)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,应如何除去?_________。
【答案】Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) 能 在沉淀溶解平衡Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq)中加入稀H2SO4时,H+与OH-发生中和反应,上述平衡右移,故Fe(OH)3可溶于稀硫酸 Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-)=1×10-39,c(OH-)=
Fe3+(aq)+3OH-(aq)中加入稀H2SO4时,H+与OH-发生中和反应,上述平衡右移,故Fe(OH)3可溶于稀硫酸 Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-)=1×10-39,c(OH-)=![]() ≈10-11.3 ,则溶液pH=2.7 Fe(OH)3 先向混合溶液中加入适量稀盐酸和H2O2溶液,再加入ZnO或Zn(OH)2或ZnCO3,调节ZnCl2溶液的pH
≈10-11.3 ,则溶液pH=2.7 Fe(OH)3 先向混合溶液中加入适量稀盐酸和H2O2溶液,再加入ZnO或Zn(OH)2或ZnCO3,调节ZnCl2溶液的pH
【解析】
(1)Fe(OH)3在溶液中存在沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),沉淀溶解平衡常数Ksp= c(Fe3+)·c3(OH-);
Fe3+(aq)+3OH-(aq),沉淀溶解平衡常数Ksp= c(Fe3+)·c3(OH-);
(2)Fe(OH)3在溶液中存在沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),向Fe(OH)3中加入稀H2SO4,H+与OH-发生中和反应,OH-浓度减小,平衡向正反应方向移动,导致Fe(OH)3溶解;
Fe3+(aq)+3OH-(aq),向Fe(OH)3中加入稀H2SO4,H+与OH-发生中和反应,OH-浓度减小,平衡向正反应方向移动,导致Fe(OH)3溶解;
(3)当FeCl3溶液中的Fe3+完全沉淀时,溶液中Fe3+离子浓度小于1×10-5 mol·L-1,则由Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)可得c(OH-);
(4)Zn(OH)2饱和溶液中c(OH-)=2×![]() ,Fe(OH)3饱和溶液中c(OH-)=2×
,Fe(OH)3饱和溶液中c(OH-)=2×![]() ,由饱和溶液中c(OH-)大小可知,Fe(OH)3的溶解度小于Zn(OH)2;
,由饱和溶液中c(OH-)大小可知,Fe(OH)3的溶解度小于Zn(OH)2;
(5)由Zn(OH)2和Fe(OH)2溶度积可知Zn(OH)2的溶解度和Fe(OH)2相等,则除去ZnCl2溶液中混有少量的Fe2+应先向混合溶液中加入适量稀盐酸和H2O2溶液,将Fe2+氧化为Fe3+,再加入ZnO或Zn(OH)2或ZnCO3与Fe3+水解生成的H+反应,促进Fe3+水解,使Fe3+水解转化为沉淀达到除杂的目的。
(1)Fe(OH)3在溶液中存在沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),沉淀溶解平衡常数Ksp= c(Fe3+)·c3(OH-),故答案为:c(Fe3+)·c3(OH-);
Fe3+(aq)+3OH-(aq),沉淀溶解平衡常数Ksp= c(Fe3+)·c3(OH-),故答案为:c(Fe3+)·c3(OH-);
(2)Fe(OH)3在溶液中存在沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),向Fe(OH)3中加入稀H2SO4,H+与OH-发生中和反应,OH-浓度减小,平衡向正反应方向移动,导致Fe(OH)3溶解,故答案为:能;在沉淀溶解平衡Fe(OH)3(s)
Fe3+(aq)+3OH-(aq),向Fe(OH)3中加入稀H2SO4,H+与OH-发生中和反应,OH-浓度减小,平衡向正反应方向移动,导致Fe(OH)3溶解,故答案为:能;在沉淀溶解平衡Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq)中加入稀H2SO4时,H+与OH-发生中和反应,上述平衡右移,故Fe(OH)3可溶于稀硫酸;
Fe3+(aq)+3OH-(aq)中加入稀H2SO4时,H+与OH-发生中和反应,上述平衡右移,故Fe(OH)3可溶于稀硫酸;
(3)当FeCl3溶液中的Fe3+完全沉淀时,溶液中Fe3+离子浓度小于1×10-5 mol·L-1,则由Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)可得,c(OH-)=![]() ≈10-11.3 ,则溶液pH=2.7,故答案为:Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-)=1×10-39,c(OH-)=
≈10-11.3 ,则溶液pH=2.7,故答案为:Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=1×10-5×c3(OH-)=1×10-39,c(OH-)=![]() ≈10-11.3 ,则溶液pH=2.7;
≈10-11.3 ,则溶液pH=2.7;
(4)Zn(OH)2饱和溶液中c(OH-)=2×![]() ,Fe(OH)3饱和溶液中c(OH-)=2×
,Fe(OH)3饱和溶液中c(OH-)=2×![]() ,由饱和溶液中c(OH-)大小可知,Fe(OH)3的溶解度小于Zn(OH)2,则向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是Fe(OH)3,故答案为:Fe(OH)3;
,由饱和溶液中c(OH-)大小可知,Fe(OH)3的溶解度小于Zn(OH)2,则向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是Fe(OH)3,故答案为:Fe(OH)3;
(5)由Zn(OH)2和Fe(OH)2溶度积可知Zn(OH)2的溶解度和Fe(OH)2相等,则除去ZnCl2溶液中混有少量的Fe2+应先向混合溶液中加入适量稀盐酸和H2O2溶液,将Fe2+氧化为Fe3+,再加入ZnO或Zn(OH)2或ZnCO3与Fe3+水解生成的H+反应,促进Fe3+水解,使Fe3+水解转化为沉淀达到除杂的目的,故答案为:先向混合溶液中加入适量稀盐酸和H2O2溶液,再加入ZnO或Zn(OH)2或ZnCO3,调节ZnCl2溶液的pH。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下表是三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 mol2·L-2 | 1.3×10-36 mol2·L-2 | 2.5×10-13 mol2·L-2 |
下列有关说法中正确的是
A.25℃时,CuS 的溶解度大于 MnS 的溶解度
B.除去某溶液中的 Cu2+,可以选用 FeS 作沉淀剂
C.因为 H2SO4 是强酸,所以反应 CuSO4+H2S = CuS↓+H2SO4不能发生
D.25℃时,饱和 CuS 溶液中,Cu2+的浓度为 1.3×10-36 mol·L-1