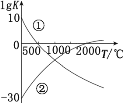
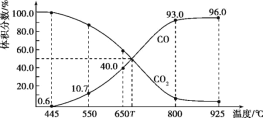
题目内容
【题目】NA表示阿伏加德罗常数的值。下列说法中,不正确的是( )
A.一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1NA
B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜
C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA
D.标准状况下,锌与某浓度的H2SO4反应生成11.2 L气体,反应中转移的电子数为6.02×1023
【答案】B
【解析】
A.2.3 g Na与氧气反应时,无论生成Na2O还是Na2O2,Na的化合价均是从0价升高到+1价,Na失去电子![]() =0.1 mol,数目为0.1NA,A正确;
=0.1 mol,数目为0.1NA,A正确;
B.由于电解精炼时阳极为粗铜,同时有其他杂质溶解,所以电路中转移NA个电子时溶解的铜小于0.5mol×64g/mol=32 g,B错误;
C.通入氯气首先与I-反应,即当Fe2+参与反应时,I-已经完全与氯气反应,所以该过程中碘离子反应转移电子数0.4NA,Fe2+反应转移电子数0.1NA,共转移电子数0.5NA,C正确;
D.标准状况下,锌与某浓度的H2SO4反应不论生成SO2还是H2,每生成1 mol都转移2mol电子,D正确;
故选B。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目