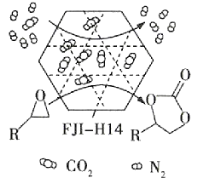
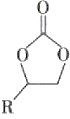
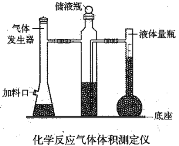
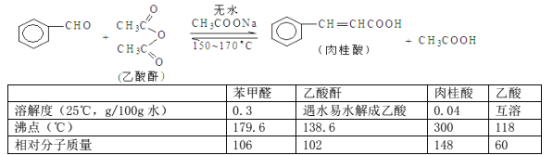
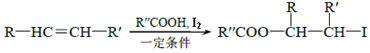【题目】中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
①称取1. 000g样品,配制成250mL待测液。
②量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
(1)将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管 _____________________________________;
(2)量取20.00mL待测液所用的仪器是_______________________;选用的指示剂为_____________________。
(3)滴定操作过程中,眼睛应注视____________________________________________;判断达到滴定终点的依据为_______________________________________________。
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作__________(填:合理或不合理)。
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,一学生提议用蒸馏水将液滴冲下去,你认为这样操作使结果_______ (填:偏高、偏低或没有影响)。
(6)第三组学生进行了两次滴定,消耗标准盐酸体积的数据如表,其中第2次滴定后滴定管的读数如图所示,将这一读数填入表中。
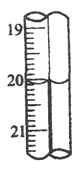
次数 | 滴定前(mL) | 滴定后 |
1 | 0.40 | 20.10 |
2 | 0.10 | ____________ |
该组学生所测得的烧碱样品中NaOH的质量分数为__________________。
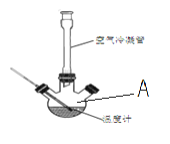
【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
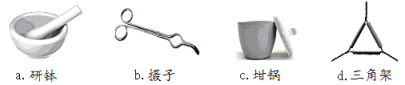
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却
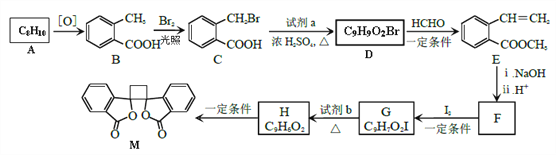
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
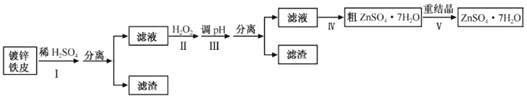
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
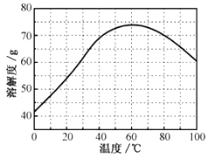
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
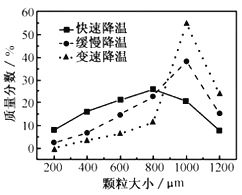
A.快速降温 B.缓慢降温 C.变速降温
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图中滴定终点是的读数是___mL。
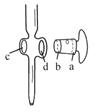

【题目】表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_________ (填元素编号) 。d、e、f三种元素的原子结构上的相同点是________________________________。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是___________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________(选填“强”、“弱’’),能说明这一事实的化学方程式是____________________(任写一个)。
(4)若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素