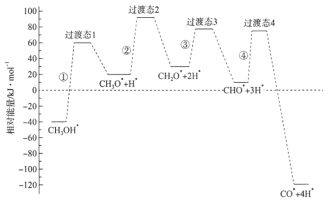
题目内容
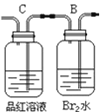
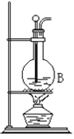
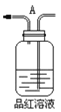
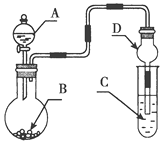
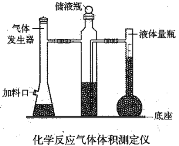
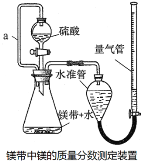
【题目】利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如图。
(1)用离子方程式表示测定实验的反应原理____________________________________。
(2)硫酸必须过量的目的是__________________________________________________。
(3)用“化学反应气体体积测定仪”测定1mol氢气的体积时,要三次用到注射器,其中两次是抽气调压,还有一次是___________________________________________。
(4)a(g)镁和足量稀硫酸反应,镁完全反应后,测得氢气在常温时的体积为V(L),则常温下l mol氢气的体积为_________________L。
(5)某学生在测定1molH2体积时,镁中混有少量铝,测定结果将_______________(填:偏大、偏小或没有变化)。
(6)若用“化学反应气体体积测定仪”也可以测定1mol二氧化碳气体的体积,那么储液瓶中应盛放________________________溶液。
(7)在“镁带中镁的质量分数测定装置”中,导管a的作用是______________________。
(8)“镁带中镁的质量分数测定”中,读取量气管的读数时,要使装置内外压强保持一致,具体操作为_________________________________________________________。
(9)在“镁带中镁的质量分数测定”中,如果实验的测定结果偏高,可能的原因是____________(选填编号)。
a.装置漏气 b.未冷却至室温即读数
c.镁带中含有氧化镁 d.末读数时量气管的液面低于水准管
【答案】Mg+2H+=Mg2++H2↑ 确保镁完全反应 加注稀硫酸 ![]() 偏大 饱和碳酸氢钠 使分液漏斗中的液体顺利滴入锥形瓶 上下移动量气管,使量气管液面和水准管内液面持平 bd
偏大 饱和碳酸氢钠 使分液漏斗中的液体顺利滴入锥形瓶 上下移动量气管,使量气管液面和水准管内液面持平 bd
【解析】
镁和稀硫酸反应生成硫酸镁和氢气;测定镁带中镁的质量分数时,镁必须反应完全;根据反应的方程式,结合镁的质量计算生成氢气的物质的量,进而计算1mol氢气的体积;二氧化碳应该不与储液瓶中盛装的溶液反应且不溶于储液瓶中盛装的溶液;导管a的作用是调节气压。
(1)测定实验的反应原理是镁和稀硫酸反应生成硫酸镁和氢气,其离子反应方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(2)镁与稀硫酸反应,为了确保镁完全反应,硫酸必须过量,故答案为:确保镁完全反应;
(3)用注射器量取一定体积的稀硫酸溶液并注入气体发生器,故答案为:加注稀硫酸;
(4)根据Mg+2H+=Mg2++H2↑,结合消耗的镁的质量可知,生成氢气的物质的量为![]() ,则常温下lmol氢气的体积为则
,则常温下lmol氢气的体积为则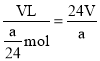 ,故答案为:
,故答案为:![]() ;
;
(5)根据Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,24g镁生成1mol氢气,18g铝生成1mol氢气,所以,镁中混有少量铝,测定结果将偏大,故答案为:偏大;
(6)CO2在饱和碳酸氢钠溶液中溶解度最小,所以储液瓶中应盛放饱和碳酸氢钠溶液;故答案为:饱和碳酸氢钠;
(7)导管a连接分液漏斗和锥形瓶,作用是调节气压,使分液漏斗中的液体顺利滴入锥形瓶,故答案为:使分液漏斗中的液体顺利滴入锥形瓶;
(8)要使装置内外压强保持一致,必须将量气管上下移动,使量气管液面和水准管内液面持平,故答案为:上下移动量气管,使量气管液面和水准管内液面持平;
(9)a. 装置漏气,导致氢气体积减小,测定结果偏低,a错误;
b. 未冷却至室温即读数,根据热胀冷缩,水中体积增大,气体体积减小,测定结果偏高,b正确;
c. 镁带中含有氧化镁,会导致生成氢气的气体减少,测定结果偏低,c错误;
d. 末读数时量气管的液面低于水准管,导致体积读大了,测定结果偏高,d正确;故答案为:bd。

 阅读快车系列答案
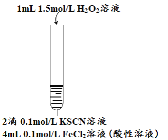
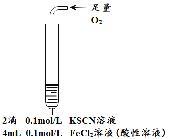
阅读快车系列答案【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
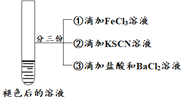
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
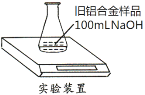
【题目】某实验小组利用如图装置,测定某种旧铝合金(含Al2O3和其它不溶于NaOH溶液的成分)中Al的质量分数,其中100mLNaOH溶液过量,每隔相同时间读得电子天平的数据如表:
称量对象 | 读数次数 | 质量(g) |
样品 | 第1次 | 2.582 |
锥形瓶+100mL NaOH溶液 | 第2次 | 185.721 |
锥形瓶+NaOH溶液+样品 | 第3次 | 188. 286 |
第4次 | 188. 254 | |
第5次 | 188. 243 | |
第6次 | 188. 243 |
(1)反应的化学方程式为_____________________________________________________、__________________________________________________。
(2)反应中产生的H2质量为___________________ g。
(3)样品中Al的质量分数为___________________(用小数表示,小数点后保留两位)。该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
(4)取出的10mL溶液中,AlO2-的物质的量浓度为_____________________________;
(5)Al2O3的质量分数_____________________(用小数表示,小数点后保留两位)。