题目内容
【题目】中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
①称取1. 000g样品,配制成250mL待测液。
②量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
(1)将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管 _____________________________________;
(2)量取20.00mL待测液所用的仪器是_______________________;选用的指示剂为_____________________。
(3)滴定操作过程中,眼睛应注视____________________________________________;判断达到滴定终点的依据为_______________________________________________。
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作__________(填:合理或不合理)。
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,一学生提议用蒸馏水将液滴冲下去,你认为这样操作使结果_______ (填:偏高、偏低或没有影响)。
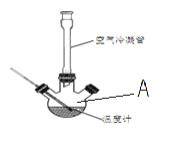
(6)第三组学生进行了两次滴定,消耗标准盐酸体积的数据如表,其中第2次滴定后滴定管的读数如图所示,将这一读数填入表中。
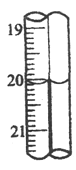
次数 | 滴定前(mL) | 滴定后 |
1 | 0.40 | 20.10 |
2 | 0.10 | ____________ |
该组学生所测得的烧碱样品中NaOH的质量分数为__________________。
【答案】250mL容量瓶 蓝色手柄滴定管或滴定管 甲基橙 锥形瓶内溶液颜色变化 当加入最后1滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不变色) 合理 没有影响 20.00 0.99
【解析】
配制一定物质的量浓度的溶液所需玻璃仪器有:烧杯、玻璃棒、胶头滴管、容量瓶;取碱性溶液时,选用碱式滴定管;滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;酸碱滴定过程中,可以反滴定;根据滴定过程中所消耗盐酸的物质的量计算出待测液中氢氧化钠的物质的量,得出氢氧化钠的质量,计算出氢氧化钠的质量分数;
(1)配制一定物质的量浓度的溶液250mL,所需玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶,故答案为:250mL容量瓶;
(2)待测液为工业烧碱,显碱性,故应选用的仪器为蓝色手柄滴定管或碱式滴定管,选用指示剂甲基橙作为指示剂,故答案为:蓝色手柄滴定管或滴定管;甲基橙;
(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色变化;当加入最后一滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不褪色)为滴定终点,故答案为:锥形瓶内溶液颜色变化;当加入最后1滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不变色);
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作合理,因为酸碱滴定过程中,可以反滴定;故答案为:合理;
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,用蒸馏水将液滴冲下去,没有影响,故答案为:没有影响;
(6)由图可知,第二次滴定后滴定管的示数为20.00mL,分析上述数据,取滴定1和滴定2的平均值计算,所需盐酸的体积为:
1/2(20.10-0.40+20.00-0.10)mL=19.8mL,1.000gNaOH配制的250mL溶液中的20mL中和盐酸的物质的量为:0.0198L×0.1000mol/L=
0.00198mol,20mLNaOH溶液中含有m(NaOH)=0.00198mol×40g/mol=0.0792g,则250mL溶液中含有NaOH的质量为0.0792g×250mL20mL=0.99g,则氢氧化钠的质量分数=0.99g/1.00g×100%=99%,故答案为:20.00mL;0.99;