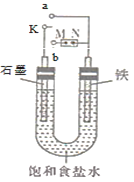
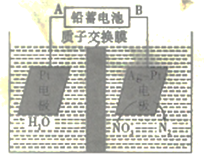
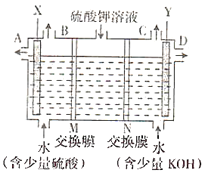
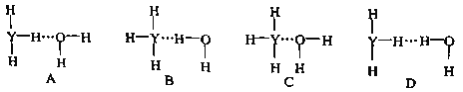
【题目】某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
(1)准确量取一定体积的待测液需要使用的仪器是________________。
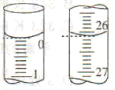
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为______mL。
(3)用盐酸标准液滴定待测烧碱样品的溶液时,________(填“左手”或“右手”,下同)握酸式滴定管的活塞,________摇动锥形瓶,眼睛始终注视________________。
(4)滴定时,若以酚酞为指示剂,滴定达到终点的标志是__________。
(5)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如表所示。
滴定次数 | 待测液体积(mL) | 0.20mol/L的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20.60 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为________。
(6)下列操作会导致测得的待测液的浓度偏大的是________(填标号)。
a.部分标准液滴出锥形瓶外
b.用待测溶液润洗锥形瓶
c.锥形瓶洗净后还留有蒸馏水
d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可用NO和Cl2合成。回答下列问题:
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) △H1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H2
③2NO(g)+Cl2(g) 2NOCl(g) △H3
则△H3=_____________(用含△H1、△H2的代数式表示)。
(2)一定温度下,向2L密闭容器中充入amol NOCl(g),发生反应2NOCl(g)2NO(g)+Cl2(g)。
①已知上述反应中正反应速率的表达式为v正=k·cn(NOCl)。300℃时,测得正反应速率与NOCl的浓度的关系如表所示:
c(NOCl)/(mol/L) | v正/(molL-1s-1) |
0.20 | 1.6×10-9 |
0.40 | 6.4×10-9 |
0.60 | 1.44×10-8 |
n=______;k=_____L·mol-1·s-1;当c(NOCl)=0.50 mol·L-1时,v正=_____mol·L-1·s-1。
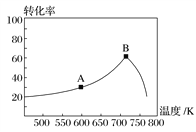
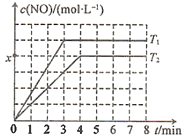
②测得NO的物质的量浓度与温度的关系如图所示(x<0.5a),T1________T2(填“>”“<”或“=”);T2温度下,该反应的平衡常数K=________mol·L-1(用含a、x的代数式表示)。
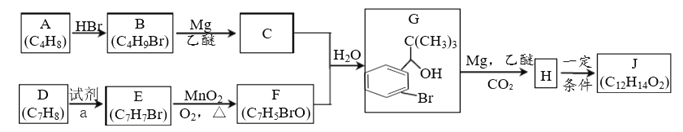
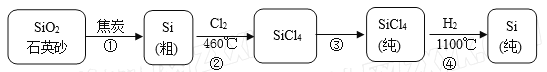
【题目】硅在地壳中的含量较高,在自然界中硅主要以硅的氧化物和硅酸盐的形式存在。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。下图为一种工业上提纯硅的路线:
相关信息如下:
a.硼、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | FeCl3 | PCl5 | Si | SiH4 |
沸点/℃ | 57.7 | 12.8 | 315 | — | 2355 | -111.9 |
熔点/℃ | -70.0 | -107.2 | — | — | 1410 | — |
升华温度/℃ | — | — | 300 | 162 | — | — |
请回答下列问题:
(1)SiCl4的电子式:________________;
(2)写出①的化学方程式________________________________________;
(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,写出发生反应的离子方程式 ______________________________________________________________
②硅能与NaOH溶液反应,但同主族元素金属锗(Ge)不易溶于NaOH溶液,但有H2O2存在时,锗能与NaOH溶液反应生成锗酸盐,请写出化学反应方程式 ______________________________________________________________
(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。写出SiH4水解的化学反应方程式 __________________________________________________________________
(5)下列有关含硅材料说法正确的是_______________ (填字母)
A. 沸点:SiCl4 > SiH4
B. 金刚砂的有效成分是氮化硅,硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 玻璃、陶瓷、水泥是广泛使用的三大新型硅酸盐材料
D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等。
E. 锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和_____________,需收集温度在_________℃左右的馏分。