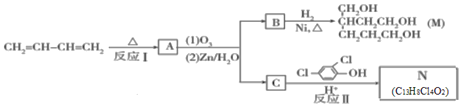
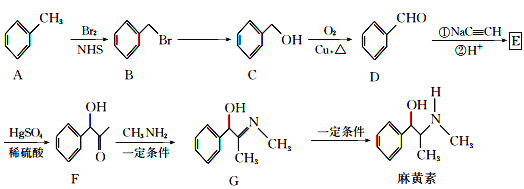
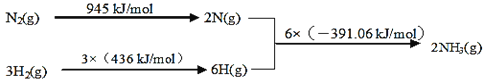
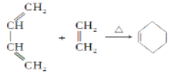��Ŀ����
����Ŀ��ij�о���ѧϰС����Ũ��Ϊ0.20 mol��L��1�������Һ�ζ�����һ�������ʵ��ռ���Ʒ(���������Ӧ)����ˮ�γɵ���Һ��
(1)ȷ��ȡһ������Ĵ���Һ��Ҫʹ�õ�������________________��
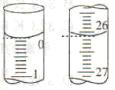
(2)���ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ�������������Һ�����Ϊ______mL��
(3)�������Һ�ζ������ռ���Ʒ����Һʱ��________(������������������������ͬ)����ʽ�ζ��ܵĻ�����________ҡ����ƿ���۾�ʼ��ע��________________��
(4)�ζ�ʱ�����Է�̪Ϊָʾ�����ζ��ﵽ�յ�ı�־��__________��
(5)��ȷ��ȡ��5.0g�ռ���Ʒ���Ƴ�250mL����Һ�����������Һ�ζ����ζ�ǰ�������ζ�����������ʾ��
�ζ����� | ����Һ���(mL) | 0.20mol/L���������(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 10.00 | 0.70 | 20.60 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
������ | 10.00 | 1.10 | 21.10 |
��ʵ�����ݿ�֪���ռ�Ĵ���Ϊ________��
(6)���в����ᵼ�²�õĴ���Һ��Ũ��ƫ�����________(����)��
a�����ֱ�Һ�γ���ƿ��
b���ô�����Һ��ϴ��ƿ
c����ƿϴ������������ˮ
d���ų���Һ�ĵζ��ܿ�ʼ�����ݣ��ų�Һ���������ʧ
���𰸡���ʽ�ζ���(����Һ��) 26.10 ���� ���� ��ƿ����Һ����ɫ�仯 �������һ�α�Һ����Һ�ɺ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ���ɫ 80% ab
��������
(1)��ΪҪ�������ľ��Ƚϸߣ����Բ���ʹ����Ͳ��Ӧʹ�õζ��ܻ���Һ�ܣ�ͬʱ��Ҫע��ζ��ܵ����͡�
(2)�ζ���ʼʱ����Ϊ0������ʱ����Ϊ26.10���ɴ˿�ȷ�����������Һ�������
(3)�������Һ�ζ������ռ���Ʒ����Һʱ����ע�������ֵķֹ����۾�ע�ӵ�Ŀ�ꡣ
(4)�ζ��ﵽ�յ�ʱ��ע����ɫ�ı仯��������ʱ�䡣
(5)����ʵ����ȡƽ��ֵ��Ȼ������c(HCl)V(HCl)=c(NaOH)V(NaOH)���м��㡣
(6)a�����ֱ�Һ�γ���ƿ�������Һ����ƫ�ࣻ
b���ô�����Һ��ϴ��ƿ�������Һ�����ʵ���ƫ��
c����ƿϴ������������ˮ���Ա�Һ������û��Ӱ�죻
d���ų���Һ�ĵζ��ܿ�ʼ�����ݣ��ų�Һ���������ʧ�����Һ������ƫ�١�
(1)ȷ��ȡһ������Ĵ���Һ��Ӧʹ�õζ��ܻ���Һ�ܣ���Ҫʹ�õ������Ǽ�ʽ�ζ���(����Һ��)����Ϊ����ʽ�ζ���(����Һ��)��
(2)��ͼ�п��Կ������ζ���ʼʱ����Ϊ0������ʱ����Ϊ26.10�������������Һ�����Ϊ26.10mL����Ϊ��26.10��
(3)�������Һ�ζ������ռ���Ʒ����Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ʼ��ע����ƿ����Һ����ɫ�仯����Ϊ�����֣����֣���ƿ����Һ����ɫ�仯��
(4)�ζ�ǰ����Һ�еμӷ�̪����Һ���ɫ���μ�������յ�ʱ��Ϊ��ɫ�����Եζ��ﵽ�յ�ı�־�ǵ������һ�α�Һ����Һ�ɺ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ���ɫ����Ϊ���������һ�α�Һ����Һ�ɺ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ���ɫ��
(5)�ӱ������ݿɵó�������ʵ���������������ֱ�Ϊ19.90mL��20.10mL��20.00mL����ƽ��������������Ϊ20.00mL��c(NaOH)=![]() =0.40mol/L��
=0.40mol/L��
��ʵ�����ݿ�֪���ռ�Ĵ���Ϊ![]() =80%����Ϊ��80%��
=80%������80%��
(6) ���ù�ʽc(NaOH)=![]() �������
�������
a�����ֱ�Һ�γ���ƿ�⣬��V(HCl)ƫ��c(NaOH)ƫ��a�������⣻
b���ô�����Һ��ϴ��ƿ����n(NaOH)ƫ������V(HCl)ƫ��c(NaOH)ƫ��b�������⣻
c����ƿϴ������������ˮ���Ա�Һ������û��Ӱ�죬c(NaOH)���䣬c�������⣻
d���ų���Һ�ĵζ��ܿ�ʼ�����ݣ��ų�Һ���������ʧ�����Һ������n(NaOH)ƫ�٣�������������ƫС��c(NaOH)ƫС��d�������⣻
�ۺ����Ϸ�����ֻ��ab�������⣬��Ϊ��ab��

 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�