题目内容
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
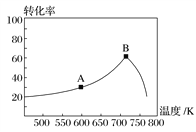
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
【答案】 N2(g)+O2(g)===2NO(g) ΔH=+183kJ·mol-1 0.25 bcd > A c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】(1)①2CO(g)+2NO(g)2CO2(g)+N2(g)△H1=-748kJmol-1,
②2CO(g)+O2(g)═2CO2(g)△H2=-565kJmol-1
在一定条件下N2和O2会转化为NO气体,反应的热化学方程式依据盖斯定律计算②-①得到:N2(g)+O2(g)═2NO(g)△H=+183KJ/mol;
(2)结合化学平衡三段式列式计算,测得10min内v(NO)=7.5×10-3molL-1min-1,反应消耗物质的量=7.5×10-3molL-1min-1×10min×2L=0.15mol
2CO(g)+2NO(g)2CO2(g)+N2(g)
起始量(mol) 0.4 0.2 0 0
变化量(mol) 0.15 0.15 0.15 0.075
平衡量(mol) 0.25 0.05 0.15 0.075
反应是气体体积减小的放热反应,依据化学平衡移动原理和影响因素分析判断,a.改变压强的同时改变温度或浓度,平衡可能逆向进行,反应是气体体积减小的反应,所以是其他条件不变时增大压强,平衡一定向右移动,故a错误;b.反应是放热反应,其它条件不变,升高温度,平衡向吸热反应方向进行,即逆向进行,但化学反应速率一定增大,故b正确;c.其它条件不变,若改为在恒压容器中进行,恒压容器中随反应进行压强比恒容容器中大,平衡正向进行,CO的平衡转化率比恒容条件下大,故c正确;d.反应是之比等于化学方程式计量数之比,为正反应速率之比,v正(NO)=2v逆(N2)说明氮气正逆反应速率相同,反应是破坏状态,故d正确;答案为bcd;(3)化学反应速率随温度升高增大,则VA<VB,NO的转化率随温度升高增大,到B点后减小,说明反应是放热反应平衡逆向进行,平衡常数减小;(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,是因为NO2-是弱酸阴离子水解显碱性,铵根离子水解显酸性,二者水解相互促进;硝酸铵溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);依据NO2-+H2OHNO2+OH-,水解平衡常数表达式Kh=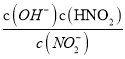 ,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=
,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=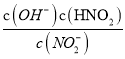 ×
×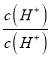 =
=![]() =
=![]() =1.4×10-11。
=1.4×10-11。

【题目】下列实验操作能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度均为0.1mol/L HClO溶液和CH3COOH溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向10mL浓度均为0.1mol/L的BaCl2和CaCl2混合溶液中加入10mL 0.1mol/L Na2SO4溶液,出现白色沉淀 | 证明Ksp(BaSO4)<Ksp(CaSO4) |
C | 向含有酚酞试液的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
D | 室温下,等体积、pH=2的HA和HB两种酸分别与足量Zn反应,HB放出的H2多 | 证明HB是强酸 |
A.AB.BC.CD.D
【题目】某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
(1)准确量取一定体积的待测液需要使用的仪器是________________。
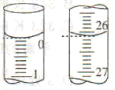
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为______mL。
(3)用盐酸标准液滴定待测烧碱样品的溶液时,________(填“左手”或“右手”,下同)握酸式滴定管的活塞,________摇动锥形瓶,眼睛始终注视________________。
(4)滴定时,若以酚酞为指示剂,滴定达到终点的标志是__________。
(5)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如表所示。
滴定次数 | 待测液体积(mL) | 0.20mol/L的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20.60 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为________。
(6)下列操作会导致测得的待测液的浓度偏大的是________(填标号)。
a.部分标准液滴出锥形瓶外
b.用待测溶液润洗锥形瓶
c.锥形瓶洗净后还留有蒸馏水
d.放出碱液的滴定管开始有气泡,放出液体后气泡消失