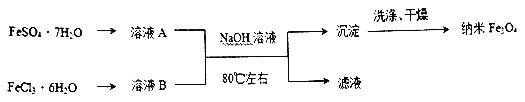
题目内容
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
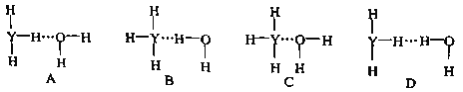
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
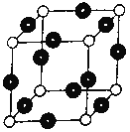
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
【答案】 ls22s22p63s23p63d104sl 面心立方最密堆积 74% C<O<N sp3 三角锥形 B Π![]() 1∶1
1∶1 
【解析】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性,Y为N元素;Z元素无正价,且基态原子有2个未成对电子,Z为O元素;基态W原子价层电子排布式为nsn-1npn-1,则n=3,W为Si元素,X与W为同主族元素,则X为C元素;基态R原子M能层全充满且核外有且仅有1个未成对电子,价层电子排布为3d104s1,R为Cu元素。
(1)基态Cu原子的核外电子排布式为ls22s22p63s23p63d104sl。铜晶体晶胞的堆积方式为面心立方最密堆积,晶胞的空间利用率为74%,故答案为:ls22s22p63s23p63d104sl;面心立方最密堆积;74%;
(2)同一周期,从左到右,元素的第一电离能逐渐增大,但N原子的2p为半充满,均为稳定,第一电离能大于O,C、N、O三种元素的第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)NF3分子中N原子上有1个孤对电子,价层电子对数为4,采用sp3杂化,分子的空间构型为三角锥形,故答案为:sp3;三角锥形;
(4)氨气溶于水生成NH3·H2O,能够电离生成铵根离子和氢氧根离子,因此氨气在水中可形成氢键,其氢键最可能的形式为是氨气分子中N原子上的孤对电子与水分子中的H原子共用,形成氢键,故选B;
(5)C的某气态氧化物的相对分子质量为44,该氧化物为二氧化碳,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为Π![]() ,二氧化碳分子中含有2个C=O,其中σ键与π数目之比为1:1,故答案为:Π
,二氧化碳分子中含有2个C=O,其中σ键与π数目之比为1:1,故答案为:Π![]() ;1∶1;
;1∶1;
(6)根据晶胞中微粒个数的分配方法计算,晶胞中含有N原子的数目为8×![]() =1,Cu原子的数目为:12×
=1,Cu原子的数目为:12×![]() =3,故化学式为Cu3N,1mol晶胞的质量为206g,所以该晶胞的边长=
=3,故化学式为Cu3N,1mol晶胞的质量为206g,所以该晶胞的边长=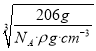 =
=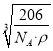 cm,故答案为:
cm,故答案为: 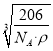 。
。