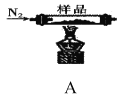
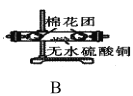
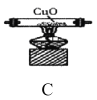
题目内容
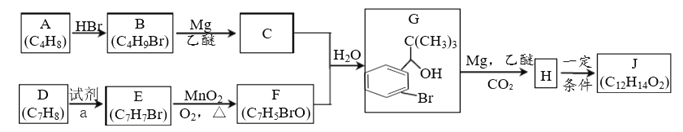
【题目】硅在地壳中的含量较高,在自然界中硅主要以硅的氧化物和硅酸盐的形式存在。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。下图为一种工业上提纯硅的路线:
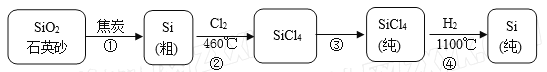
相关信息如下:
a.硼、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | FeCl3 | PCl5 | Si | SiH4 |
沸点/℃ | 57.7 | 12.8 | 315 | — | 2355 | -111.9 |
熔点/℃ | -70.0 | -107.2 | — | — | 1410 | — |
升华温度/℃ | — | — | 300 | 162 | — | — |
请回答下列问题:
(1)SiCl4的电子式:________________;
(2)写出①的化学方程式________________________________________;
(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,写出发生反应的离子方程式 ______________________________________________________________
②硅能与NaOH溶液反应,但同主族元素金属锗(Ge)不易溶于NaOH溶液,但有H2O2存在时,锗能与NaOH溶液反应生成锗酸盐,请写出化学反应方程式 ______________________________________________________________
(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。写出SiH4水解的化学反应方程式 __________________________________________________________________
(5)下列有关含硅材料说法正确的是_______________ (填字母)
A. 沸点:SiCl4 > SiH4
B. 金刚砂的有效成分是氮化硅,硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 玻璃、陶瓷、水泥是广泛使用的三大新型硅酸盐材料
D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等。
E. 锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和_____________,需收集温度在_________℃左右的馏分。
【答案】 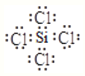 SiO2 + 2C
SiO2 + 2C![]() Si + 2CO SiO2 + 2OH- = SiO32- + H2O Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O SiH4 + (n+2)H2O = SiO2·n H2O↓ + 4H2 (SiO2·n H2O写沉淀符号) ADE 蒸馏 57.7
Si + 2CO SiO2 + 2OH- = SiO32- + H2O Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O SiH4 + (n+2)H2O = SiO2·n H2O↓ + 4H2 (SiO2·n H2O写沉淀符号) ADE 蒸馏 57.7
【解析】(1)SiCl4中Si分别与Cl形成1对共用电子对,所以电子式为: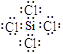 ;(2)根据流程可知,反应①是石英砂与焦炭在高温条件下反应生成粗硅和一氧化碳,其化学方程式为:SiO2 + 2C
;(2)根据流程可知,反应①是石英砂与焦炭在高温条件下反应生成粗硅和一氧化碳,其化学方程式为:SiO2 + 2C![]() Si + 2CO;(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的离子方程式为:SiO2 + 2OH- = SiO32- + H2O;②金属锗(Ge)在H2O2存在下溶于NaOH溶液,生成锗酸盐的化学反应方程式为:Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O;(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。SiH4水解的化学反应方程式为:SiH4+ (n+2)H2O= SiO2·n H2O↓+ 4H2↑;(5)A.分子晶体中,组成和结构相似,相对分子质量越大,沸点越高,则沸点:SiCl4 > SiH4 ,选项A正确;B. 金刚砂的有效成分是碳化硅,选项B错误;C. 玻璃、陶瓷、水泥是广泛使用的三大传统硅酸盐材料,选项C错误;D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等,选项D正确;E. 同主族元素从上而下金属性逐渐增强,对应的氢氧化钠的碱性逐渐增强,锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4,选项E正确。答案选ADE;(6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和蒸馏,根据图中数据可知,需收集温度在57.7℃左右的馏分,以得到氯化硅。
Si + 2CO;(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的离子方程式为:SiO2 + 2OH- = SiO32- + H2O;②金属锗(Ge)在H2O2存在下溶于NaOH溶液,生成锗酸盐的化学反应方程式为:Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O;(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。SiH4水解的化学反应方程式为:SiH4+ (n+2)H2O= SiO2·n H2O↓+ 4H2↑;(5)A.分子晶体中,组成和结构相似,相对分子质量越大,沸点越高,则沸点:SiCl4 > SiH4 ,选项A正确;B. 金刚砂的有效成分是碳化硅,选项B错误;C. 玻璃、陶瓷、水泥是广泛使用的三大传统硅酸盐材料,选项C错误;D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等,选项D正确;E. 同主族元素从上而下金属性逐渐增强,对应的氢氧化钠的碱性逐渐增强,锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4,选项E正确。答案选ADE;(6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和蒸馏,根据图中数据可知,需收集温度在57.7℃左右的馏分,以得到氯化硅。

【题目】氨气常用作合成氯氨类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NCl3),副产物少于其它水消毒剂。
回答下列问题:
(1)工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=___kJ/mol。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生完全水解,生成具有强烈杀菌消毒作用的物质,该水解反应的化学方程式为___。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
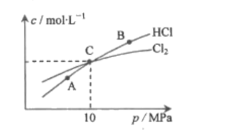
①A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C")。
②计算C点时该反应的压强平衡常数Kp(C)=____(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图),总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
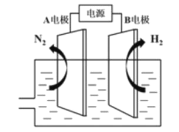
①A电极连接电源的___极(填"正”或“负”)。
②A电极的电极反应为___。