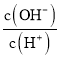【题目】有三种镁铝合金样品(组分比例不一定相同)①、②、③。小奉、小贤、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究:
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为___________。(保留小数点后面2位)
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是_________。(结果转化为最简分数)
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
实验序号 | a | b | c |
合金质量(g) | 0.51 | 0.765 | 0.918 |
气体体积(mL) | 560 | 672 | 672 |
求:I.盐酸的物质的量浓度_______
II.合金中镁的质量分数_______
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL_______?