题目内容
【题目】氨气是化工生产的主要原料之一,氨气的用途非常广泛。在一固定容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,发生如下反应: N2(g)+3H2(g)![]() 2NH3(g)△H=-Q kJ/mol(Q>0)。
2NH3(g)△H=-Q kJ/mol(Q>0)。
(1)该反应所用的催化剂是_______(填写名称);该反应450℃时的平衡常数______500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是_______
A. 3v正(H2)=2v逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol计算从反应开始到平衡时,平均反应速率v(N2)为______________。
(4)在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,则产生的NH3的物质的量比原平衡产生的NH3______(填“多”或“少”或”“一样”)。
(5)工厂生产的氨水稀释后可作肥料。稀释氨水时,随着水的增加溶液中减少的是_______
a.  b.
b. 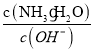 c.
c. 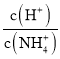 d.
d. 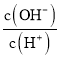
(6)液氨和水类似,也能电离:2NH3![]() NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:____。
【答案】铁触媒 > BD 0.01 mol/(Lmin) 多 bd = c(NH3)>c(NH2-)>c(Na+)>c(NH4+)
【解析】
(1)工业合成氨的催化剂是以铁为载体的催化剂为铁触媒,正反应是放热反应,温度升高,化学平衡向逆反应方向进行,平衡常数减小,反应450℃的平衡常数大于500℃时的平衡常数;
(2)A. 化学反应速率之比等于系数之比,当2v正(H2)=3v逆(NH3)才证明平衡,A错误;
B. 该反应是反应前后气体体积改变的反应,若气体的物质的量不变,反应达到平衡;
C. 结合气体的质量和体积分析;
D. 根据气体的物质的量的变化分析;
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol,根据速率定义式计算然后根据反应速率之比等于化学方程式系数之比,平均反应速率v(N2);
(4) N2(g)+3H2(g)![]() 2NH3(g)是气体体积减小的反应,随着反应的进行,气体的物质的量减小,体系的压强减小,在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,随着反应的进行,体系的压强不变,与原平衡相比,相当于增大压强,然后利用压强对化学平衡移动的影响分析;
2NH3(g)是气体体积减小的反应,随着反应的进行,气体的物质的量减小,体系的压强减小,在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,随着反应的进行,体系的压强不变,与原平衡相比,相当于增大压强,然后利用压强对化学平衡移动的影响分析;
(5)根据氨水中的反应平衡、电离平衡移动分析解答;
(6)①K只与温度有关,温度不变K值不变;
②根据浓度对电离平衡移动的影响分析判断。
(1)工业合成氨的催化剂是以铁为载体的催化剂为铁触媒,正反应是放热反应,温度升高,化学平衡向逆反应方向进行,平衡常数减小,反应450℃的平衡常数大于500℃时的平衡常数;
(2)A. 化学反应速率之比等于系数之比,当2v正(H2)=3v逆(NH3)才证明平衡,A错误;
B. 该反应是反应前后气体体积改变的反应,气体的质量不变,若气体的物质的量不变,单位物质的量的气体的质量不变,气体的平均相对分子质量![]() 也不变,反应达到平衡,B正确;
也不变,反应达到平衡,B正确;
C. 容器中气体的密度=![]() ,气体的质量和体积总是不变,所以气体的密度始终保持不变,则不能根据密度不变判断反应是否处于平衡状态,C错误;
,气体的质量和体积总是不变,所以气体的密度始终保持不变,则不能根据密度不变判断反应是否处于平衡状态,C错误;
D. 容器中气体的分子总数不随时间而变化证明各组分浓度保持不变了,反应达到平衡状态,D正确;
故合理选项是BD;
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol,从反应开始到平衡时,氨气的反应速v(HN3)= =0.02 mol/(Lmin),由于反应速率之比等于化学方程式系数之比,平均反应速率v(N2)=0.5×v(NH3)=0.01 mol/(Lmin);
=0.02 mol/(Lmin),由于反应速率之比等于化学方程式系数之比,平均反应速率v(N2)=0.5×v(NH3)=0.01 mol/(Lmin);
(4) N2(g)+3H2(g)![]() 2NH3(g)是气体体积减小的反应,随着反应的进行,气体的物质的量减小,体系的压强减小,在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,随着反应的进行,体系的压强不变,与原平衡相比,相当于增大压强,增大压强,化学平衡向气体体积减小的正反应方向移动,则反应达到平衡时产生的NH3的物质的量比原平衡时多;
2NH3(g)是气体体积减小的反应,随着反应的进行,气体的物质的量减小,体系的压强减小,在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,随着反应的进行,体系的压强不变,与原平衡相比,相当于增大压强,增大压强,化学平衡向气体体积减小的正反应方向移动,则反应达到平衡时产生的NH3的物质的量比原平衡时多;
(5)在氨水中存在化学平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
a.加水稀释氨水时,c(NH4+)、c(NH3·H2O)都降低,电离平衡正向移动,使c(NH3·H2O)减小的倍数大于c(NH4+),所以 增大,a不符合题意;
增大,a不符合题意;
b.加水稀释氨水时,c(OH-)、c(NH3·H2O)都降低,电离平衡正向移动,使c(NH3·H2O)在稀释的基础上进一步减小,而c(OH-)在稀释的基础上又有所增加,所以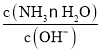 减小,b符合题意;
减小,b符合题意;
c. 稀释氨水时,氢氧根离子和铵根离子的浓度减小,氢离子的浓度增大,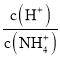 增大,c不符合题意;
增大,c不符合题意;
d. /span>稀释氨水时,氢氧根离子和铵根离子的浓度减小,氢离子的浓度增大,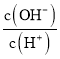 的值减小, d符合题意;
的值减小, d符合题意;
故合理选项是bd;
(6)①K只与温度有关,温度不变K值不变,所以在该温度下加入NH4Cl后,液NH3电离平衡常数K=2×10-30;
②液氨存在电离平衡:2NH3![]() NH4++ NH2-,电离程度是微弱的,主要以NH3形式存在,将少量金属钠投入液氨中,2NH4++2Na=NH3↑+2Na++H2↑,反应消耗NH4+,使电离平衡正向移动,但平衡移动的趋势是微弱的,所以最终达到平衡时,其中离子浓度大小关系为c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
NH4++ NH2-,电离程度是微弱的,主要以NH3形式存在,将少量金属钠投入液氨中,2NH4++2Na=NH3↑+2Na++H2↑,反应消耗NH4+,使电离平衡正向移动,但平衡移动的趋势是微弱的,所以最终达到平衡时,其中离子浓度大小关系为c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】有三种镁铝合金样品(组分比例不一定相同)①、②、③。小奉、小贤、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究:
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为___________。(保留小数点后面2位)
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是_________。(结果转化为最简分数)
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
实验序号 | a | b | c |
合金质量(g) | 0.51 | 0.765 | 0.918 |
气体体积(mL) | 560 | 672 | 672 |
求:I.盐酸的物质的量浓度_______
II.合金中镁的质量分数_______
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL_______?