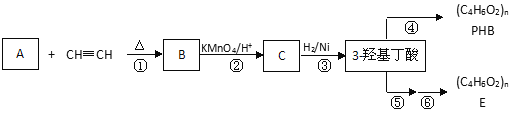
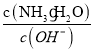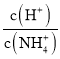题目内容
【题目】有三种镁铝合金样品(组分比例不一定相同)①、②、③。小奉、小贤、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究:
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为___________。(保留小数点后面2位)
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是_________。(结果转化为最简分数)
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
实验序号 | a | b | c |
合金质量(g) | 0.51 | 0.765 | 0.918 |
气体体积(mL) | 560 | 672 | 672 |
求:I.盐酸的物质的量浓度_______
II.合金中镁的质量分数_______
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL_______?
【答案】47.06% 0.80V<m2<1.07V 2.0 mol/L 47.06% 78 mL
【解析】
(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、2Al(OH)3![]() Al2O3+3H2O,得到的固体是Al2O3,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数;
Al2O3+3H2O,得到的固体是Al2O3,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数;
(2)采用极限法计算固体质量范围;
(3)Ⅰ.先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
Ⅱ.根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
Ⅲ.根据方程式中转化关系以及原子守恒计算。
(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O= NaHCO3+Al(OH)3↓、2Al(OH)3![]() Al2O3+3H2O,得到的固体是氧化铝,原固体为Mg、Al,反应后固体为Al2O3,反应前后固体质量不变,Mg的质量与Al2O3中O元素质量相等,则镁元素质量分数等于氧化铝中的氧元素质量分数,故合金中镁元素的质量分数=
Al2O3+3H2O,得到的固体是氧化铝,原固体为Mg、Al,反应后固体为Al2O3,反应前后固体质量不变,Mg的质量与Al2O3中O元素质量相等,则镁元素质量分数等于氧化铝中的氧元素质量分数,故合金中镁元素的质量分数=![]() ×100%=47.06%;
×100%=47.06%;
(2)假设全部是Mg,设镁的质量为x,Mg+2H+=Mg2++H2 ↑根据方程式可知24 gMg完全反应产生1 mol H2,其在标准状况下的体积为22.4 L,则x g Mg反应放出H2的体积为V,则![]() =
=![]() ,解得x=1.07V;
,解得x=1.07V;
假设合金全部是Al,设铝的质量是y,根据反应方程式2Al+6H+=2Al3++3H2↑可知:54 gAl完全反应产生3 mol H2,在标准状况下体积为67.2 L,y g Al反应产生H2的体积是V L,则![]() ,解得y=0.80V;
,解得y=0.80V;
因为是两种金属的合金,所以金属的质量介于0.80V与1.07V之间,即0.80V<m<1.07V;
(3)Ⅰ.b、c中生成的气体体积相同,c中金属的质量较大,则c中盐酸反应完全,n(H2)=![]() =0.03 mol,则n(HCl)=2n(H2)=0.06 mol,所以c(HCl)=
=0.03 mol,则n(HCl)=2n(H2)=0.06 mol,所以c(HCl)=![]() =2 mol/L;
=2 mol/L;
Ⅱ.a组合金完全反应,假设合金中Mg、Al的物质的量分别为x mol、y mol,则有:
24x+27y=0.510g,根据电子得失数目相等可知2x+3y=![]() ×2,解得x=0.01,y=0.01,则Mg的质量分数w(Mg)=
×2,解得x=0.01,y=0.01,则Mg的质量分数w(Mg)=![]() ×100%=47.06%;
×100%=47.06%;
Ⅲ.盐酸最终转化为NaCl,Al转化为NaAlO2,则由HCl~NaCl和Al~NaAlO2可知:
n(NaCl)=n(HCl)=2.0 mol/L×0.030 L=0.06 mol;
n(NaAlO2)=n(Al)=0.01 mol×![]() =0.018 mol;
=0.018 mol;
根据Na+守恒得:n(NaOH)= n(NaCl)+ n(NaAlO2)=0.06 mol+0.018 mol=0.078 mol
故V(NaOH)=![]() =0.078 L=78 mL。
=0.078 L=78 mL。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________