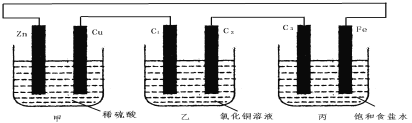
题目内容
【题目】下面A~F是几种常见的烃的分子球棍模型,根据这些模型回答下列问题:

(1)常温下含碳量最高的液态烃是___________。
(2)能够发生加成反应的烃为____________。
(3)一氯代物的同分异构体最多的是___________(以上填对应字母)。
(4)由C制备聚合物的反应类型为____________。
(5)有机物G、H与E具有相同实验式,其中G相对分子质量是E相对分子质量的![]() ,H相对分子质量是E相对分子质量的
,H相对分子质量是E相对分子质量的![]() ,G不能使溴水褪色,只有一种环境氢,G的结构简式为_________。H是芳香化合物,能使溴水褪色,H的结构简式为_________。
,G不能使溴水褪色,只有一种环境氢,G的结构简式为_________。H是芳香化合物,能使溴水褪色,H的结构简式为_________。
【答案】E CEF F 加聚反应 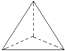
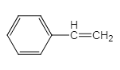
【解析】
根据分子球棍模型可知A为甲烷,B为乙烷,C为乙烯,D为丙烷,E为苯,F为甲苯,根据物质的组成、分类、结构、性质进行解答。
(1)常温下液态烃为苯和甲苯,其分子式分别为C6H6、C7H8,二者中含碳量最高的是C6H6,故答案为:E;
(2)能够发生加成的烃为:乙烯、苯和甲苯,故答案为:CEF;
(3)甲烷的一氯代物有1种,乙烯的一氯代物有1种,苯的一氯代物有1种,甲苯的一氯代物有4种,一卤代物种类最多的是甲苯,故答案为:F;
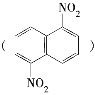
(4)C为乙烯,结构中含碳碳双键,故能发生加聚反应得聚乙烯,故答案为:加聚反应;(5)有机物G与E苯有相同最简式,即G的最简式为CH,且G式量是E式量的三分之二,故G的分子式为C4H4,由于G不能使溴水褪色,只有一种环境氢,即G的结构非常对称,故G的结构简式为 ;有机物H与E苯有相同最简式,即H的最简式为CH,而H式量是E式量的4/3倍,故H的分子式为C8H8,共有5个不饱和度,H是芳香化合物,苯环含有4个不饱和度,又能使溴水褪色,所以苯环的支链上有碳碳双键,所以H的结构简式为
;有机物H与E苯有相同最简式,即H的最简式为CH,而H式量是E式量的4/3倍,故H的分子式为C8H8,共有5个不饱和度,H是芳香化合物,苯环含有4个不饱和度,又能使溴水褪色,所以苯环的支链上有碳碳双键,所以H的结构简式为 ,故答案为:
,故答案为: ;
; 。
。

 阅读快车系列答案
阅读快车系列答案【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D