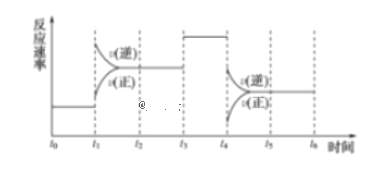
��Ŀ����
����Ŀ����ҵ�ϳ�����������ʢװ���Ũ���ᡣΪ�о����ʲ�����Ũ����ķ�Ӧ��ijѧϰС�����������̽�����
[̽��һ]
(1)��ͬѧ����ȥ�����������������(̼�ظ�)������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ����________________��
(2)��ͬѧ����ȡ����10.0 g����25.0 mLŨ�����У����ȣ����Ӧ��õ���ҺX���ռ�������Y����ͬѧ��ΪX�п��ܺ���Fe3+Ҳ���ܺ���Fe2+����Ҫȷ�ϴ˽��ۣ�Ӧ��_________ѡ����ţ���
a. KSCN��Һ b. ���ۺ�KSCN��Һ c. ��ˮ d. ����KMnO4��Һ
(3)��ͬѧȡ448 mL(��״��)����Yͨ��������ˮ�У���ˮ��ɫ��������Ӧ�����ӷ���ʽΪ��______��Ȼ���������BaCl2��Һ�����ʵ�������ø������2.33 g���ɴ���֪����Y��SO2���������Ϊ_____��
[̽����]
������ͬѧʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�г�ˮ��������ܺ���Z��W���塣Ϊ�����������̽��ʵ��װ��(ͼ�мг�����ʡ��)��
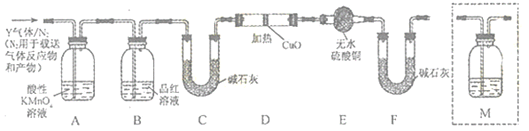
(4)װ��B���Լ���������____________��
(5)��ͬѧ��Ϊ����ͼ�е�D��E��Fװ�ÿ�֤������Y�л�����Z����Z����Ϊ_______(��ѧʽ)��֤��Z�����ʵ������Ϊ__________��Fװ�õ�������_________
(6)��Ϊ����Y�л�����W��������__________(�û�ѧ����ʽ��ʾ)��Ϊȷ��W�Ĵ��ڣ�����װ��������M��_______��ѡ����ţ���
a. A֮ǰ b. A��B�� c. B��C�� d. C��D��
���𰸡����ѱ��ۻ� ad SO2+Br2+2H2O=4H++SO42-+2Br- 50% ����SO2�Ƿ���� H2 �����ɺ�ɫ��Ϊ��ɫ������ˮ����ͭ��Ϊ��ɫ ��ֹ������ˮ���뵽E C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O c
CO2��+2SO2��+2H2O c
��������
(1)����(̼�ظ�)������Ũ�����У�Ũ�����н�ǿ����������ʹ�����ۻ���
(2)����Fe3+������ѡ�����軯����Һ������Fe2+��������+2��Fe2+��ʹ�ữ��KMnO4��ɫ�����飻
(3)���ɵ�SO2���л�ԭ�ԣ�ͨ��������ˮ�У�����SO2+Br2+2H2O=2HBr+H2SO4��������Ԫ�ص��غ㣬��Ϲ�ϵʽ��SO2��BaSO4���SO2�����������
(4) SO2��ʹƷ����Һ��ɫ���Ӷ�����SO2�Ƿ������
(5)����װ��D��E�е�ҩƷ������ϡ���ᷴӦ������������������CuO��ɺ�ɫ����ˮ����ͭ������֤������H2��������ˮ�ּ���װ��E�������ʵ���ж�ˮ�IJⶨ��
(6)�����к���̼Ԫ�أ�̼��Ũ�����ڼ��������·�Ӧ����CO2��SO2���壻CO2�ܹ�����ʯ�����գ�����Ӧ�÷���Ʒ����Һ֮��ʯ��֮ǰ��λ�á�
(1)����(̼�ظ�)������Ũ�����У�Ũ�����н�ǿ����������ʹ�����������һ�����ܵ������ﱡĤ����ֹ�����Ľ�һ���������������ۻ��������ֹ��Ӧ��һ�����У�
(2) Fe3+��SCN-��Ӧ���ɺ�ɫ��Fe(SCN)3��ʹ��Һ��ΪѪ��ɫ�������Fe3+����ѡ��KSCN��Һ��+2��Fe2+���л�ԭ�ԣ���ʹ�ữ�ĸ�����ر���ԭΪMn2+����ɫ���ʺ���Fe2+���������Ը��������Һ���飬���Ժ���ѡ����ad��ȷ��
(3)SO2���л�ԭ�ԣ�ͨ��������ˮ�У�������Ӧ����ʽΪ��SO2+Br2+2H2O=2HBr+H2SO4�����ӷ���ʽΪ��SO2+Br2+2H2O=4H++SO42-+2Br-��
n(�������)=![]() =0.02 mol��SO2��Ӧ��ת��ΪBaSO4������SԪ���غ�ɵ�n(SO2)=
=0.02 mol��SO2��Ӧ��ת��ΪBaSO4������SԪ���غ�ɵ�n(SO2)=![]() =0.01 mol����ͬ����������õ����֮�ȵ������ʵ���֮�ȣ�����������SO2���������Ϊ��
=0.01 mol����ͬ����������õ����֮�ȵ������ʵ���֮�ȣ�����������SO2���������Ϊ��![]() ��100%=50%��
��100%=50%��
(4)A�������dz�ȥSO2��SO2����Ư���ԣ���ʹƷ����Һ��ɫ������B�������Ǽ���A�е�SO2�Ƿ���ȫ������
(5)ϡ����������Ӧ����FeSO4��H2��D��E��Fװ�ÿ���֤����ZΪH2��H2��ԭCuO������ˮ������ʹ��ɫ��CuSO4��ĩ����ɫ��ͬʱ�к�ɫ��Cu�������ɣ�����ɫ�����죬����ˮ����ͭ��������֤����������к���H2��װ��E���ڼ����Ƿ���ˮ���ɣ������е�ˮ�ָ��Ÿ�ʵ�飬����װ��F�������Ƿ�ֹ������ˮ���뵽װ��E�У�
(6)�ڼ���ʱ�����������е�����Ũ���ᷴӦ��CҲ��ŨH2SO4��Ӧ����CO2��SO2��H2O����Ӧ����ʽΪ��C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O��WΪCO2��CO2��SO2����ʹ����ʯ��ˮ����ǣ�Ӱ���˶�CO2�IJⶨ��������CO2�ܹ�����ʯ�����գ�����װ��MӦ�÷���Ʒ����Һ֮��ʯ��֮ǰ��λ�ã���Mװ�÷���B-C�䣬�ʺ���ѡ����c��
CO2��+2SO2��+2H2O��WΪCO2��CO2��SO2����ʹ����ʯ��ˮ����ǣ�Ӱ���˶�CO2�IJⶨ��������CO2�ܹ�����ʯ�����գ�����װ��MӦ�÷���Ʒ����Һ֮��ʯ��֮ǰ��λ�ã���Mװ�÷���B-C�䣬�ʺ���ѡ����c��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��![]() ����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�
����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�

�������ͻ���ͪ�IJ����������ʼ��±���
���� | ��Է������� | �е�(��) | �ܶ�(g��cm��3��20��) | �ܽ��� |
������ | 100 | 161.1 | 0.9624 | ������ˮ���� |
����ͪ | 98 | 155.6 | 0.9478 | ����ˮ���������� |
����20 mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ�������ᴿ�������漰����Ҫ����(δ����)��
a.����ȥ���Ѻ��ռ�151��156����֣�
b.ˮ��������(���ѷе�34.6 ������ȼ��)��ȡ����ȡҺ�����л��㣻
c.���ˣ�
d.��Һ���м���NaCl���������ͣ����ã���Һ��
e.������ˮMgSO4���壬��ȥ�л���������ˮ��
�ش��������⣺
(1)���������ᴿ�������ȷ˳����__________ (����ĸ)��
(2)b��ˮ����������ȡ��Ŀ����_______��
(3)���¹�����ȡ��Һ�����������У�����ȷ����__________��
A.ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������ͼ������
B.���κ����Һ©���ϿڵIJ���������
C.���������������ֳַ�Һ©�����ô�Һ��ֲ�
D.��Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©�����ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
(4)����������d�У�����NaCl�����������__________����������ѵIJ����в��õļ��ȷ�ʽΪ________��
(5)�������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������______��