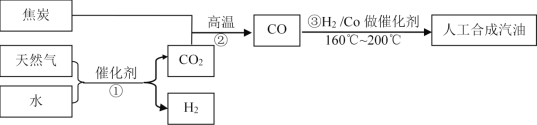
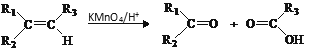
题目内容
【题目】铅是一种金属元素,可用作耐酸腐蚀、蓄电池等的材料。其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有_______种能量不同的电子,其次外层的电子云有_______种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是______(填化学式),气态氢化物沸点最低的是_____________(填化学式)。
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
__PbO2+___MnSO4+___HNO3 →___HMnO4+___Pb(NO3)2+___PbSO4↓+____ ____
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为_______个。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
【答案】3 1 H2CO3 CH4 5 2 6 2 3 2 2H2O 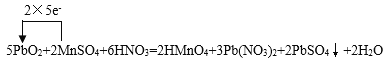 2NA B
2NA B
【解析】
(1)IVA中原子序数最小的元素的原子为C,其核外电子排布式为1s22s22p2,则碳原子有1s、2s和3p三种能量不同的电子;C的次外层为s轨道,为球形对称结构;
(2)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强;同一主族元素中,氢化物的相对分子质量越大,分子间作用力越大,其沸点越高;
(3)根据氧化还原反应中化合价升降相等配平,然后利用单线桥表示出该反应中电子转移的方向和数目;
(4)根据n=c·V计算出铅离子的物质的量,根据反应计算出硫酸铅的物质的量,再根据化合价变化计算出转移电子的物质的量及数目;
(5)根据(3)可知二氧化铅的氧化性大于氯气,二氧化铅与浓盐酸发生氧化还原反应生成氯化铅、氯气和水,据此进行判断。
(1)IVA中原子序数最小的元素为C,C原子核外有6个电子,其核外电子排布式为1s22s22p2,则碳原子有1s、2s和3p三种能量不同的电子;C的次外层为1s轨道,为球形对称结构,只存在1种不同的伸展方向;
(2)IVA中非金属性最强的为C,则其最高价氧化物对应的水化物的酸性最强,该物质为碳酸,其化学式为:H2CO3;
对于结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点就越高。IVA族元素中,CH4的相对分子质量最小,则其沸点最低;
(3)PbO2中Pb的化合价从+4变为+2价,化合价降低2价;MnSO4中锰元素化合价从+2变为+7,化合价升高5价,则化合价变化的最小公倍数为10,所以二氧化铅的系数为5,硫酸锰的稀释为2,然后利用质量守恒定律可知生成物中未知物为H2O,配平后的反应为:5PbO2+2MnSO4+6HNO3=2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O,用单线桥表示电子转移的方向和数目为: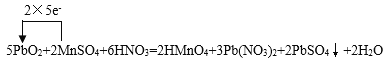 ;
;
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol/L,则反应生成铅离子的物质的量为:n(Pb2+)=c·V=0.6 mol/L×1 L=0.6 mol,硫酸铅中铅离子的物质的量为0.4 mol,则反应中转移电子的物质的量为:(0.6+0.4) mol×(4-2)=2 mol,反应转移电子的数目为2NA;
(5)根据(3)可知氧化性:PbO2>HMnO4,而HMnO4能够氧化Cl-,所以PbO2能够氧化Cl-,二者反应的化学方程式为:PbO2+4HCl→PbCl2+Cl2↑+2H2O,故合理选项是B正确。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
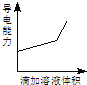
A.AB.BC.CD.D