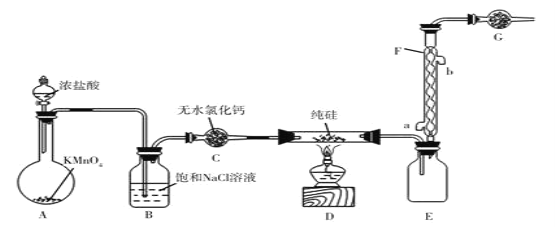
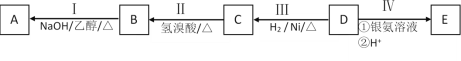
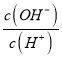【题目】氧化亚铜(Cu2O)可用于陶瓷、固体整流器,可用下列反应制备:2(CuSO4H2O)![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为________________。上述反应中,电负性最大的元素是________________(填元素符号)
(2)元素Cu和Ni相邻,其第一、二电离能数据如表所示:
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
铜的第一、二电离能都比镍对应的高,其原因除了铜的核电荷数比多,对外电子的吸外力大外,还有一个原因是________。
(3)已知H2SO4的结构式如图所示,上述反应中:

①在上述产物中,VSEPR模型与SO42-相同的是________(填化学式)
②SO3分子的立体构型是________________,写出一种与SO3互为等电子体的离子:________(填离子符号)
(4)Cu2+、Cu+与CN-、OH-、NH3、H2O等组成多种配离子。[Cu(NH3)4]2+中的Cu2+配位数为________。
(5)铜元素和氧元组成一种晶体M,M的晶胞如图所示。

已知:NA是阿伏加德罗常数的值,M晶体密度为dgcm-3。M的晶胞中Cu+、Cl-个数比为________,晶胞参数为________pm(用含d和NA的代数式表示)。(用含d和NA的代数式表示)
【题目】甲醚(CH3OCH3)是一种新型能源。
已知①CO(g)+2H2(g)CH3OH(g) H1=-99kJ/mol
②2CH3OH(g)CH3OCH3(g)+H2O(g) H2=-24kJ/mol
③CO(g)+H2O(g)CO2(g)+H2(g) H3=-41kJ/mol
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式:________________。
(2)下列措施能提高反应①中CO的平衡转化率的是________(填字母)。
A.增大压强 B.升高温度 C.增大H2浓度 D.加高效催化剂
(3)在恒温恒容条件下只发生反应③,下列情况表明该反应达到平衡的是________(填字母)。
A.气体压强保持不变 B.气体密度保持不变
C.![]() 保持不变 D.浓度商保持不变
保持不变 D.浓度商保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中投入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)的有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
[φ(CH3OCH3)] | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①30min时,CH3OH的转化率α(CH3OH)________%;该温度下,上述反应的平衡常数K=________(用分数表示)。
②反应速率v=v正-v逆,其中v正=k正φ2(CH3OH)、v逆=k逆φ(CH3OCH3)φ(H2O),k正、k逆分别为正、逆反应速率常数,只与温度有关,φ为物质的量分数。15min时![]() ________(结果保留2位小数)
________(结果保留2位小数)
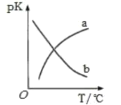
(5)在密闭容器中发生反应③,平衡常数为K,pK=-lg2K。pK温度的关系如图所示,图中曲线________(填“a”或“b”)能反映平衡常数变化趋势。
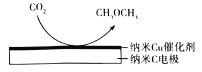
(6)在CO2处理过的饱和KHCO3溶液中,电解活化的CO2制备CH3OCH3的原理如图所示,阴极有HCO3-生成,该电的电极反应式为________。