题目内容
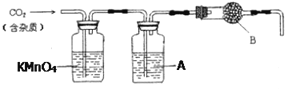
【题目】某化学活动小组设计以下装置进行不同实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c烧杯中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是_________(填序号),该装置中应加入试剂___________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是_________,该物质的作用是______________________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是__________(填序号),写出该反应的化学方程式_______________。用制得的乙醛溶液进行银镜反应,正确的操作顺序是_________(填序号)。
①向试管中滴入3滴乙醛溶液。
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止。
③振荡后放入热水中水浴加热。
④在洁净的试管中加入1mL 2%的AgNO3溶液。
【答案】D 饱和Na2CO3溶液 碎瓷片或沸石 防暴沸 A、B、C ![]() ④②①③
④②①③
【解析】
(1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置(导管口为插入溶液中,目的是防止倒吸)吸收乙醇,中和乙酸,降低乙酸乙酯溶解度;A装置液体加热沸腾需要加入碎瓷片或沸石防止暴沸;
(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,冷却得到液体乙醛;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象;
(3)乙醛分子间易形成加合物(C2H4O)n而不能发生银镜反应,说明分子中无醛基;醛基中羰基相互加成形成环状结构。
(1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置(导管口为插入溶液中,目的是防止倒吸),加入饱和碳酸钠溶液,吸收乙醇,中和乙酸,降低乙酸乙酯溶解度;A装置液体加热沸腾需要加入碎瓷片或沸石,防止暴沸;
(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,反应的化学方程式为:![]() ,冷却得到液体乙醛装置连接为A、B、C;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象,实验顺序是④②①③。
,冷却得到液体乙醛装置连接为A、B、C;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象,实验顺序是④②①③。

 阅读快车系列答案
阅读快车系列答案【题目】氧化亚铜(Cu2O)可用于陶瓷、固体整流器,可用下列反应制备:2(CuSO4H2O)![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为________________。上述反应中,电负性最大的元素是________________(填元素符号)
(2)元素Cu和Ni相邻,其第一、二电离能数据如表所示:
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
铜的第一、二电离能都比镍对应的高,其原因除了铜的核电荷数比多,对外电子的吸外力大外,还有一个原因是________。
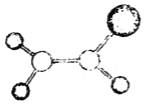
(3)已知H2SO4的结构式如图所示,上述反应中:

①在上述产物中,VSEPR模型与SO42-相同的是________(填化学式)
②SO3分子的立体构型是________________,写出一种与SO3互为等电子体的离子:________(填离子符号)
(4)Cu2+、Cu+与CN-、OH-、NH3、H2O等组成多种配离子。[Cu(NH3)4]2+中的Cu2+配位数为________。
(5)铜元素和氧元组成一种晶体M,M的晶胞如图所示。

已知:NA是阿伏加德罗常数的值,M晶体密度为dgcm-3。M的晶胞中Cu+、Cl-个数比为________,晶胞参数为________pm(用含d和NA的代数式表示)。(用含d和NA的代数式表示)