题目内容
【题目】有X、Y、Z三种短周期元素,已知X原子L层电子比M层电子多2个, Y3+离子电子层结构与Ne相同;Z与X处于同一周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出元素X名称:________ ;
(2)写出Y元素在元素周期表的位置_______________ ;
(3)画出元素Z的原子结构示意图:___________________ ;
(4)Z元素所在主族的元素形成的含氧酸酸性最强的是(写化学式)____________;
(5)X的氢化物的电子式为______________;
(6)写出Y单质与氢氧化钠溶液反应化学方程式_________________;
(7)标准状况下,2.24LZ单质与足量氢氧化钙完全反应时,电子转移总数为_____mol。
【答案】硫 第3周期第ⅢA族 ![]() HClO4
HClO4 ![]()
![]() 0.1
0.1
【解析】
已知X原子L层电子比M层电子多2个,则X为S;Y3+离子电子层结构与Ne相同,则Y为Al;Z与X处于同一周期,其气态单质是双原子分子,两原子共用1对电子,则Z为Cl,以此答题。
经分析,X为S,Y为Al,Z为Cl;
(1)元素X名称为硫;
(2)Y元素在元素周期表的位置第3周期第ⅢA族;
(3)元素Z的原子结构示意图为:![]() ;
;
(4)Z元素所在主族的元素形成的含氧酸酸性最强的是HClO4;
(5)X的氢化物为H2S其电子式为:![]() ;
;
(6)Y单质与氢氧化钠溶液反应化学方程式:![]() ;
;
(7)标准状况下,2.24L Z单质与足量氢氧化钙完全反应:![]() ,电子转移总数
,电子转移总数![]() 。
。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。
Ⅰ.某研究小组设计了一套制备及检验SO2部分性质的装置,如图所示:
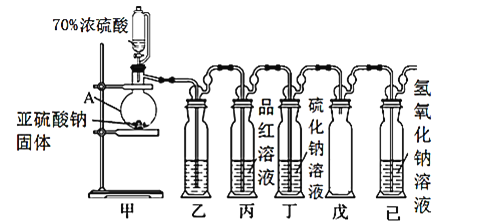
(1)仪器A的名称____________。
(2)装置乙的作用是为了观察生成SO2的速率,则装置乙中加入的试剂是____________。
(3)①实验前有同学提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2,因此装置丁中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学反应方程式____________。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表:
序号 | 实验操作 | 实验现象 |
1 | 向10 mL 1 mol/L Na2S溶液中通O2 | 15 min后,溶液才出现浑浊 |
2 | 向10 mL 1 mol/L Na2S溶液中通SO2 | 溶液立即出现黄色浑浊 |
由实验现象可知:该实验条件下Na2S溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是____________。
Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是以氮气为载体,以稀盐酸、淀粉和碘化钾的混合溶液为吸收液,用0.0010 mol·L-1KIO3标准溶液进行滴定。检测装置如图所示:
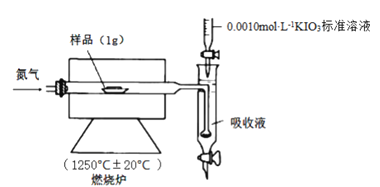
[查阅资料] ①实验进行5min样品中的S元素都可转化为SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2O=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
(4)工业设定的滴定终点现象是____________。
(5)实验一:不放样品进行实验,5 min后测得消耗标准液体积为V1
实验二:加入1 g样品再进行实验,5 min后测得消耗标准液体积为V2
①比较数据发现V1远远小于V2,可忽略不计。则设置实验一的目的是___________。
②测得V2的体积如表:
序号 | 1 | 2 | 3 |
KIO3标准溶液体积/mL | 10.02 | 9.98 | 10.00 |
该份铁矿石样品中硫元素的质量百分含量为____________。