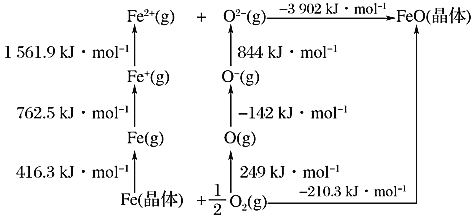
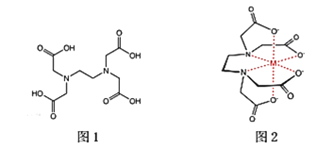
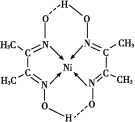
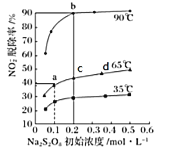
0 202440 202448 202454 202458 202464 202466 202470 202476 202478 202484 202490 202494 202496 202500 202506 202508 202514 202518 202520 202524 202526 202530 202532 202534 202535 202536 202538 202539 202540 202542 202544 202548 202550 202554 202556 202560 202566 202568 202574 202578 202580 202584 202590 202596 202598 202604 202608 202610 202616 202620 202626 202634 203614