题目内容
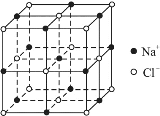
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。从-1价的气态阴离子再得到1个电子,成为-2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。FeO是离子晶体,其晶格能可通过如下的Born-Haber循环计算得到。
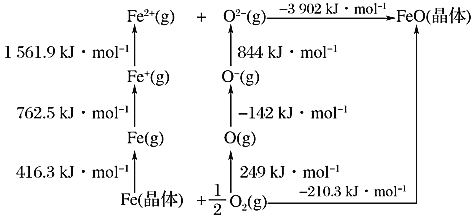
铁单质的原子化热为__________kJ/mol,FeO的晶格能为__________kJ/mol,基态O原子E1____________E2(填“大于”或“小于”),从原子结构角度解释_________。
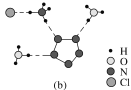
(2)乙二胺四乙酸又叫做EDTA(图1),是化学中一种良好的配合剂,形成的配合物叫做螯合物。EDTA在配位滴定中经常用到,一般是测定金属离子的含量。已知:EDTA配离子结构(图2)。
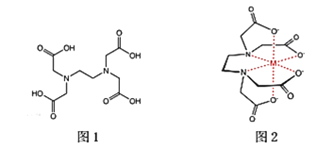
EDTA中碳原子轨道的杂化类型为____________,EDTANa-Fe(Ⅲ)是一种螯合物,六个配位原子在空间构型为____________。EDTANa-Fe(Ⅲ)的化学键除了σ键和配位键外,还存在____________。
(3)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O 围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为__________,有__________%的正八面体空隙填充阳离子。Fe3O4晶胞的八分之一是图示结构单元(图3),晶体密度为5.18 g/cm3,则该晶胞参数a=____________pm。(写出计算表达式)

【答案】416.3 3902 小于 当负一价氧离子再获得电子时要克服电荷之间的排斥力,因此要吸收能量 sp2,sp3 八面体 离子键和π键 1:2 50% ![]() ×1010
×1010
【解析】
(1)从原子化能、晶格能概念,结合图示的能量变化判断;根据图示O原子的E1、E2比较大小,并从电性作用分析判断;
(2)根据单键是sp3杂化,共价双键是sp2杂化分析;根据EDTANa-Fe(Ⅲ)的结构中原子相对位置、结合其结构分析判断;
(3)根据晶体结构分析,由密度公式ρ=![]() 进行计算。
进行计算。
(1)根据图示可知Fe晶体变为1 mol气态Fe原子时需吸收416.3 kJ的热量,所以铁单质的原子化热为416.3 kJ/mol;根据图示可知1 mol气态Fe2+与1 mol气态O2-会放出3902 kJ的热量,则FeO的晶格能为3902 kJ/mol;1 mol基态气态O原子获得1 mol 电子变为1 mol气态O-离子,放出能量是142 kJ,则O原子的E1=-142 kJ/mol,而基态O原子E2为+844 kJ/mol,E1<E2,这是由于O-带一个单位的负电荷,当负一价氧离子再获得电子时要克服电荷之间的排斥力,因此要吸收能量,所以E1<E2;
(2)根据EDTA的结构简式可知,该物质分子中含有的C原子,结合了四个其它原子,形成四个单键,这类C原子杂化类型为sp3杂化;有的C结合三个其它原子,含有双键,这类碳原子轨道的杂化类型为sp2杂化;根据图示可知:在Fe3+周围连接4个O原子,2个N原子,在两个顶点含有2个O原子,在中间平面上有2个N原子、2个O原子,构成的是八面体结构;EDTANa-Fe(Ⅲ)是离子化合物,含有离子键,阴离子是复杂离子,含有共价单键、共价双键,共价单键为σ键,共价双键中含有1个σ键和1个π键,在Fe3+原子上含有空轨道,在与之结合的N、O原子上含有孤对电子,与中间的Fe3+形成配位键,所以在该化合物中除了含有σ键和配位键外,还存在π键和离子键。
(3)结构中如1、3、6、7的O2-围成的正四面体空隙有8个,由图可知晶体结构中O2-离子数目为8×![]() +6×
+6×![]() =4个,则O2-离子数目与正四面体空隙数之比为4:8 =1:2;
=4个,则O2-离子数目与正四面体空隙数之比为4:8 =1:2;
Fe3O4中有一半的Fe3+填充到正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则有50%的正八面体空隙没有填充阳离子,含有Fe3+和Fe2+的总数为3,晶胞中有8个图示结构单元,不妨取1 mol这样的晶胞,则1 mol晶胞的质量为m=8×(3×56+4×16) g=8×232 g,1 mol晶胞即有6.02×1023个晶胞,1个晶胞的体积为V=(a×10-10)3 cm3,所以晶体密度为ρ= a/cm3=5.18 g/cm3,所以该晶胞参数a=
a/cm3=5.18 g/cm3,所以该晶胞参数a=![]() ×1010pm。
×1010pm。