题目内容
【题目】脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol
②N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
③H2O(g)![]() H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol
写出常温下,NH3还原NO反应的热化学方程式:____________。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为____________。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为____________;60~80℃ NO脱除率下降可能的原因为____________。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
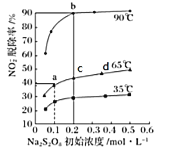
①a、b、c、d四点平衡常数K由大到小的顺序为____________,原因是____________。
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=____________。(用含a的代数式表示)
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为_______。
【答案】4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=-2069.9 kJ/mol HNO3(或NO3-) 温度升高,化学反应速率加快 温度升高,气体溶解度下降(或温度升高,ClO-水解增强) K(b)>K(a)=K(c)=K(d) 温度相同,化学平衡常数相同,a、c、d三点在同一温度下,K值相同;该反应的正反应为吸热反应,b点温度升高,NO2的脱除率上升,说明升高温度,化学平衡向正向移动,K值增大
5N2(g)+6H2O(l) △H=-2069.9 kJ/mol HNO3(或NO3-) 温度升高,化学反应速率加快 温度升高,气体溶解度下降(或温度升高,ClO-水解增强) K(b)>K(a)=K(c)=K(d) 温度相同,化学平衡常数相同,a、c、d三点在同一温度下,K值相同;该反应的正反应为吸热反应,b点温度升高,NO2的脱除率上升,说明升高温度,化学平衡向正向移动,K值增大 ![]() O2+2e-+2H+=H2O2
O2+2e-+2H+=H2O2
【解析】
(1)常温下氨气还原NO产生N2和液体水,方程式为4NH3+6NO![]() 5N2+6H2O,将已知三个热化学方程式叠加,可得该反应的热化学方程式;
5N2+6H2O,将已知三个热化学方程式叠加,可得该反应的热化学方程式;
(2)①根据反应过程中电子守恒分析判断;②根据温度、浓度或盐的水解等原因分析;
(3)①平衡常数只与温度有关,温度相同,化学平衡常数相同,根据温度与NO2-的脱除率的关系,结合平衡移动原理分析;
②根据pH计算溶液中c(H+),利用水的离子积计算c(OH-),结合NO2-脱除率及各种物质的浓度计算第二步反应的平衡常数K的数值;
(4)根据电解池反应原理分析。
(1)根据盖斯定律,将①-②×5+③×6,整理可得4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=-2069.9 kJ/mol;
5N2(g)+6H2O(l) △H=-2069.9 kJ/mol;
(2)①Ca(ClO)2具有氧化性,NO具有还原性,二者发生氧化还原反应时物质的量之比为3:4,反应后ClO-反应变为Cl-,假设NO反应后被氧化,产物中N元素化合价为+x,根据电子守恒可知3×2×2=4×(x-2),解得x=+5价,所以脱除后NO转化为+5价的HNO3(或NO3-);
②在图中,40~60℃NO脱除率上升可能是由于温度升高,化学反应速率加快,可以使NO更快反应,导致NO脱除率增大;随温度升高,当温度在60~80℃NO脱除率又随温度的升高而下降可能是由于温度升高使气体NO在溶液中气体溶解度下降(或温度升高,ClO-水解增强);
(3)根据图象可知:在Na2S2O8初始浓度相同时,温度越高,NO2-脱除率越大,说明升高温度,化学平衡正向移动,化学平衡常数增大,在相同温度下,化学平衡常数相同,与物质的浓度大小无关,所以a、b、c、d四点平衡常数K由大到小的顺序为b>a=c=d,即K(b)>K(a)=K(c)=K(d);
②对于反应,NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O,由于开始时c(NO2-)=a mol/L,c(S2O82-)=0.1 mol/L,NO2-的平衡脱除率为40%,所以根据物质反应转化关系可知,平衡时c(NO2-)=0.6a mol/L,c(S2O82-)=(0.1-0.4a) mol/L,c(NO2-)=0.4a mol/L,c(SO42-)=0.8a mol/L,平衡时pH=13,则该溶液中c(OH-)=0.1 mol/L,所以该反应的化学平衡常数K=
NO3-+2SO42-+H2O,由于开始时c(NO2-)=a mol/L,c(S2O82-)=0.1 mol/L,NO2-的平衡脱除率为40%,所以根据物质反应转化关系可知,平衡时c(NO2-)=0.6a mol/L,c(S2O82-)=(0.1-0.4a) mol/L,c(NO2-)=0.4a mol/L,c(SO42-)=0.8a mol/L,平衡时pH=13,则该溶液中c(OH-)=0.1 mol/L,所以该反应的化学平衡常数K= ;
;
(4)根据已知的物质转化关系可知:在过程A中,O2得到电子,与溶液中的H+结合形成H2O2,电极反应为:O2+2e-+2H+=H2O2,该电极得到电子,发生还原反应,即为阴极的电极反应式;在过程B中,NO失去电子,与H2O结合形成NO,产生产生H+,电极反应为:NO-2e-+H2O=NO2+2H+,总反应方程式为:O2+H2O+NO=NO2+H2O2。

【题目】工业上常釆用乙苯催化脱氢制苯乙烯,方程式为:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)已知:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol﹣1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_____kJmol﹣1。
(2)①利用计算结果与反应特点,选择理论上有利于提高苯乙烯平衡产率的条件_____。
A.低温 B.高温 C.高压 D.低压 E.合适的催化剂
②实际工业生产中常伴有乙苯裂解等副反应。而乙苯裂解反应无论在热力学还是在动力学上都比乙苯脱氢更有利,所以工业生产要使反应向脱氢方向进行需要采用_____条件来提高反应的选择性。
③工业生产中常采用恒压条件下向乙苯蒸汽中掺入水蒸气或CO2的办法来提高乙苯的平衡转化率,请从平衡移动的角度加以说明_____。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:
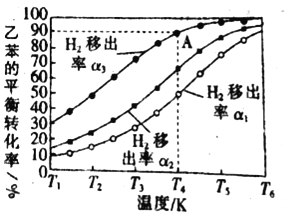
氢气移出率α![]()
①同温度时α1、α2、α3依次_____,(填“增大”“减小”)原因是_____。
②A点平衡常数为0.45mol/L,则α为_____。