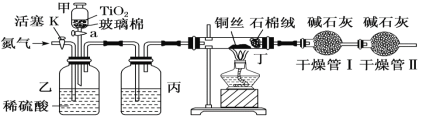
题目内容
【题目】运送“神舟”五号飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为_________。
(2)该物质与液态双氧水反应能产生两种无毒又不污染环境的物质,写出该反应的化学方程式_______________________。
(3)NH3分子中的N原子有一对孤对电子 能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
_________________________________________。
【答案】![]() N2H4+2H2O2=N2+4H2O N2H4+2HCl= N2H6Cl2
N2H4+2H2O2=N2+4H2O N2H4+2HCl= N2H6Cl2
【解析】
(1)该氮氢化合物中N(H)=![]() =4,故分子中N(N)=
=4,故分子中N(N)=![]() =2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为
=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为![]() ;
;
(2)N2H4与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,则生成氮气与水,反应的化学方程式为N2H4+2H2O2=N2+4H2O;
(4)N2H4分子中每个N原子都含有1对孤对电子,故1molN2H4与2molHCl反应生成N2H6Cl2,反应的化学方程式为N2H4+2HCl= N2H6Cl2。
解:(1)该氮氢化合物中N(H)=![]() =4,故分子中N(N)=
=4,故分子中N(N)=![]() =2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为
=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为![]() ,
,
故答案为![]() ;
;
(2)N2H4与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,则生成氮气与水,该反应化学方程式为:N2H4+2H2O2=N2+4H2O,
故答案为N2H4+2H2O2=N2+4H2O;
(4)N2H4分子中每个N原子都含有1对孤对电子,故1molN2H4与2molHCl反应生成N2H6Cl2,反应方程式为:N2H4+2HCl=N2H6Cl2,
故答案为N2H4+2HCl=N2H6Cl2.

【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
【题目】纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)过氧化氢中氧元素的化合价是__。
(2)实验室中用过氧化氢制取氧气的化学方程式为__。
(3)同学们用0.1000mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被__(填“氧化”或“还原”);酸性高锰酸钾溶液应装在__(填“酸式”或“碱式”)滴定管中。
②当滴入最后一滴酸性高锰酸钾标准溶液,__即滴定到达终点。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
则试样中过氧化氢的浓度为___mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果__(填“偏低”、“偏高”或“不变”)。
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲乙两位同学的说法是否正确:__。