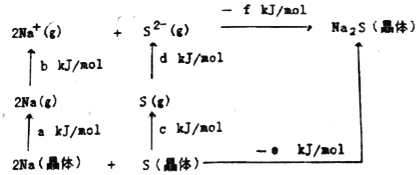��Ŀ����
����Ŀ�������������ʵ���Ҫ���������ʽṹ,��ش��������⡣
(1)��֪A��BΪ��������Ԫ��,��ԭ�ӵĵ�һ�����ĵ��������±���ʾ:
������/kJ��mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1 817 | 2 745 | 11 578 |
B | 738 | 1 451 | 7 733 | 10 540 |
Aͨ���� ��,A�ĵ縺�� B�ĵ縺��(��������������������=��)��
(2)�����Ĺ��������е�����ԼΪ399 kJ��mol-1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ,˵�����峤ʱ������������Ƥ�������˺���ԭ�� ��
��ɵ����ʵ���İ������е�̼ԭ���ӻ������� ��
���ۼ� | C��C | C��N | C��S |
����/kJ��mol-1 | 347 | 305 | 259 |
(3)ʵ��֤��:KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ����(��ͼ��ʾ),��֪3�����Ӿ���ľ������������±�:
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol-1 | 786 | 715 | 3 401 |

���4�����Ӿ���(������NaCl)�۵�Ӹߵ��͵�˳����: ������MgO������һ��Mg2+��Χ�������ڽ��ҵȾ����Mg2+�� ����
(4)���������Ӻ�δ�ɶԵ���Խ��,�����Խ��,�ż�¼����Խ�á�������������V2O5��CrO2��,�ʺ���¼�����ŷ�ԭ�ϵ��� ��
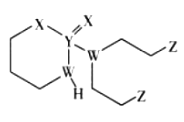
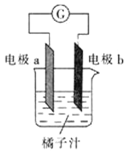
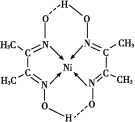
(5)ij�����ķ��ӽṹ��ͼ��ʾ,������ڲ����� (�����)��
A���Ӽ���B���Լ���C��������D��λ����E�����F�Ǽ��Լ�
���𰸡�(1)+3 ��
(2)�������е������ȵ����ʷ�������Ҫ��ѧ��C��C��C��N��C��S�ļ��ܶ���,��������������ʹ��Щ��ѧ������,�Ӷ��ƻ������ʷ��� sp2��sp3
(3)TiN��MgO��CaO��KCl 12
(4)CrO2
(5)C
��������(1)����A�ĵ�4������ͻȻ����ܶ�,Aͨ����ʾ+3��;����B�ĵ�3������ͻȻ����,���ж�Bͨ����ʾ+2��,�������ڱ���,A��B���ұ�,��A�ĵ縺�Դ���B��
(2)���ݱ������ݿ�֪�������������е��������ڵ������и��ֻ�ѧ���ļ���,����������ƻ��������л�ѧ�������ƻ������ʡ�
(3)���Ӿ��徧����Խ��,�۷е�Խ�ߡ������������������������ĵ�ɵij˻�������,����������֮��ľ���ɷ���,�ҵ�ɵ�Ӱ�����,TN���������Ӹ���3����λ���,CaO�и���2����λ���,MgO�и���2����λ���,KCl�и���1����λ���,���۷е�ߵ�Ϊ:TN��MgO��CaO��KCl��������ĺڵ����Mg2+,��ÿ������е����,����12����
(4)V�ļ۵����Ų�Ϊ3d34s2,��V5+û��δ�ɶԵ���,��Cr�ļ۵����Ų�Ϊ3d54s1,��Cr4+��2��δ�ɶԵĵ���,��CrO2��Ϊ¼�����ŷ�ԭ�ϡ�
(5)����ͼʾ�ɿ���,OΪ������,��һ����λ�����,�ʺ����Ӽ�;N��Ni֮�������λ��,O��H֮�������Ϊ���,N��C��C��H��֮���Ǽ��Թ��ۼ�,C��C֮��Ϊ�Ǽ��Թ��ۼ���

����Ŀ��������ͭ(Cu2O)�������մɡ��������������������з�Ӧ�Ʊ���2(CuSO4H2O)![]() Cu2O+SO2��+SO3��+O2��+10H2O���ش��������⣺
Cu2O+SO2��+SO3��+O2��+10H2O���ش��������⣺
(1)Cu2O�л�̬ͭ�����ӵļ۲�����Ų�ͼΪ________________��������Ӧ�У��縺������Ԫ����________________����Ԫ�ط���)
(2)Ԫ��Cu��Ni���ڣ����һ�������������������ʾ��
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
ͭ�ĵ�һ���������ܶ�������Ӧ�ĸߣ���ԭ�����ͭ�ĺ˵�����ȶ࣬������ӵ����������⣬����һ��ԭ����________��
(3)��֪H2SO4�Ľṹʽ��ͼ��ʾ,������Ӧ�У�

�������������У�VSEPRģ����SO42-��ͬ����________(�ѧʽ)
��SO3���ӵ����幹����________________��д��һ����SO3��Ϊ�ȵ���������ӣ�________�������ӷ���)
(4)Cu2+��Cu+��CN-��OH-��NH3��H2O����ɶ��������ӡ�[Cu(NH3)4]2+�е�Cu2+��λ��Ϊ________��
(5)ͭԪ�غ���Ԫ���һ�־���M��M�ľ�����ͼ��ʾ��

��֪��NA�ǰ����ӵ�������ֵ��M�����ܶ�Ϊdgcm-3��M�ľ�����Cu+��Cl-������Ϊ________����������Ϊ________pm(�ú�d��NA�Ĵ���ʽ��ʾ)��(�ú�d��NA�Ĵ���ʽ��ʾ)