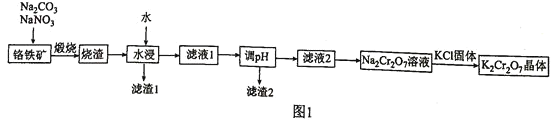
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
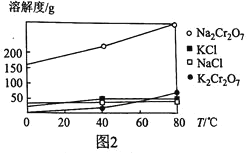
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
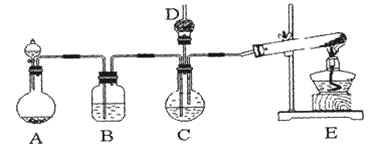
【题目】某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
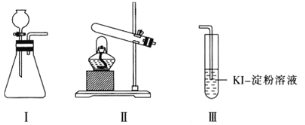
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的____中加入质量分数为30%的H2O2溶液,连接装置I、III,打开活塞 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
丙 | 向装置II中加入____,向装置III中再加入适量0.1mol·L-1的H2SO4溶液,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________(填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________(写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________。