题目内容
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
【答案】B < 其他条件相同时,T2K下,生成N2的速率较快(或其他条件相同时,T2K下,反应达到平衡所用的时间更短) 2.75![]() 10-2mol/(L·min) 70%
10-2mol/(L·min) 70%
【解析】
(1)由表中数据可知,T2K时先达到平衡,反应速率大,则T2>T1,且升高温度,氮气的物质的量减少,则平衡逆向移动,正反应放热,即△H<0,由方程式可知,该反应正反应是气体的物质的量增多的反应,故正反应为熵增过程,即△S>0;
答案选B;
(2)T1<T2,理由是其他条件相同时,T2K下,生成N2的速率较快(或其他条件相同时,T2K下,反应达到平衡所用的时间更短);
(3)T1K下,0~20min内v(NO)=![]() v(N2)=
v(N2)=![]() ×
×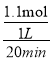 =2.75
=2.75![]() 10-2mol/(L·min);
10-2mol/(L·min);
(4)T2K下,平衡时,N2的物质的量为1.4mol,则NO2消耗![]() ×1.4mol=0.7mol,平衡转化率为
×1.4mol=0.7mol,平衡转化率为![]() =70%。
=70%。

 习题精选系列答案
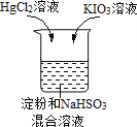
习题精选系列答案【题目】某同学进行如下趣味化学实验:
将HgCl2溶液和KIO3溶液同时加入 | 反应原理: ①IO ②IO ③Hg2++2I-=HgI2↓(橙红色) |
现象:先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色 |
下列说法不正确的是( )
A.反应①中IO![]() 表现了氧化性
表现了氧化性
B.反应①对反应②的进行有促进作用
C.该实验条件下,反应速率:③>②
D.用Na2SO3溶液代替NaHSO3进行实验,现象相同
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O