题目内容
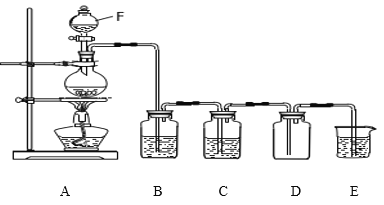
【题目】某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
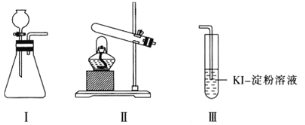
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的____中加入质量分数为30%的H2O2溶液,连接装置I、III,打开活塞 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
丙 | 向装置II中加入____,向装置III中再加入适量0.1mol·L-1的H2SO4溶液,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________(填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________(写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________。
【答案】分液漏斗 KMnO4固体 O2+4I-+4H+=2I2+2H2O 酸性环境 使用同体积不同浓度的稀硫酸做对比实验 A 3I2+6OH-=5I-+IO3-+3H2O 在上述未变蓝的溶液中滴入0.1molL-1 H2SO4溶液,观察现象,若溶液变蓝则猜想正确,否则错误
【解析】
(1)甲实验:根据裝置Ⅰ不要加热制取氧气可以知道利用的是双氧水的分解,过氧化氢在二氧化锰催化作用下分解生成氧气,I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝说明生成碘单质;
(2)碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式;
(3)对比乙、丙实验可以知道,O2与KI溶液发生反应的适宜条件酸性环境,酸溶液中氢离子浓度不同,装置Ⅲ中出现蓝色的速率不同;
(4)证明Ⅰ中产生的气体中含有双氧水,氧气和双氧水都具有氧化性,需要利用不同性质进行检验;
(5)该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,可能是生成的碘单质在碱溶液中发生反应生成碘化钾、碘酸钾,验证是否正确是在未变蓝色的溶液中滴入稀硫酸观察是否变蓝。
(1)甲实验:根据装置Ⅰ不需要加热制取氧气可以知道利用的是双氧水的分解,过氧化氢在二氧化锰催化作用下分解生成氧气,向Ⅰ的锥形瓶中加入MnO2固体,向Ⅰ的分液漏斗中加入30%H2O2溶液,连接Ⅰ、Ⅲ,打开活塞,Ⅰ中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝说明生成碘单质,故答案为:分液漏斗;
(2)碘离子具有还原性,在酸性条件下能够被氧化成碘单质,据此写出反应的离子方程式为: O2+4I-+4H+=2I2+2H2O,故答案为:O2+4I-+4H+=2I2+2H2O;
(3)向装置Ⅱ中加入KMnO4固体,连接装置II、III,点燃酒精灯,Ⅲ中有气泡冒出,溶液不变蓝,向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol·L-1的H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液变蓝。对比乙、丙实验可以知道,O2与KI溶液发生反应的适宜条件是:酸性环境;为进一步探究该条件对反应速率的影响,可采取的实验措施是:使用不同浓度的稀硫酸作对比实验,故答案为:酸性环境;使用不同浓度的稀硫狻作对比实验;
(4)A.高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故A正确;
B.氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故B错误;
C.高锰酸钾和氧气都能够氧化硫化氢,无法用硫化氢检验混合气体中是否含有双氧水,故C错误;
故答案为:A;
(5)KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应的离子方程式为3I2+6OH-=5I-+IO3-+3H2O,设计实验证明他们的猜想是否正确的实验方案为:在上述未变蓝的溶液中滴入0.1molL-1 H2SO4溶液,观察现象,若溶液变蓝则猜想正确,否则错误,故答案为:3I2+6OH-=5I-+IO3-+3H2O;在上述未变蓝的溶液中滴入0.1molL-1 H2SO4溶液,观察现象,若溶液变蓝则猜想正确,否则错误。

【题目】下列实验设计能够成功的是 ( )
实验目的 | 实验步骤及现象 | |
A | 检验亚硫酸钠试样是否变质 | 试样 |
B | 检验某盐是否为铵盐 | 试样 |
C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
D | 除去氯化钠晶体中少量硝酸钾 | 试样 |
A.AB.BC.CD.D