ЬтФПФкШн
ЁОЬтФПЁПФбШмаддгТБЪЏЃЈK2SO4MgSO42CaSO42H2OЃЉЪєгкЁАДєПѓЁБЃЌдкЫЎжаДцдкШчЯТЦНКт
K2SO4MgSO42CaSO42H2OЃЈsЃЉ2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
ЮЊФмГфЗжРћгУМизЪдДЃЌгУБЅКЭCaЃЈOHЃЉ2ШмвКШмНўдгТБЪЏжЦБИСђЫсМиЃЌЙЄвеСїГЬШчЭМ1ЃК
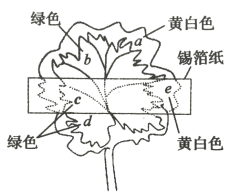
ЃЈ1ЃЉТЫдќжївЊГЩЗжга__________КЭ___________вдМАЮДШмдгТБЪЏЃЎ
ЃЈ2ЃЉгУЛЏбЇЦНКтвЦЖЏдРэНтЪЭCaЃЈOHЃЉ2ШмвКФмШмНтдгТБЪЏНўГіK+ЕФдвђЃК_______________ЃЎ
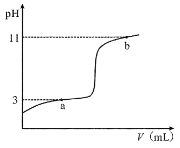
ЃЈ3ЃЉЁАГ§дгЁБЛЗНкжаЃЌЯШМгШы_______ШмвКЃЌОНСАшЕШВйзїКѓЃЌЙ§ТЫЃЌдйМгШы________ШмвКЕїТЫвКPHжСжаадЃЎ
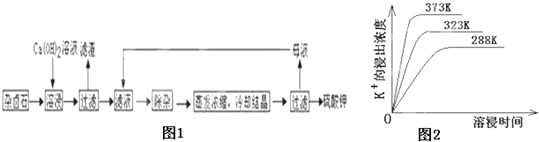
ЃЈ4ЃЉВЛЭЌЮТЖШЯТЃЌK+ЕФНўГіХЈЖШгыШмНўЪБМфЕФЙиЯЕЪЧЭМ2ЃЌгЩЭМПЩЕУЃЌЫцзХЮТЖШЩ§ИпЃЌЂй__________________________Ђк______________________________ЃЛ
ЃЈ5ЃЉгаШЫвдПЩШмадЬМЫсбЮЮЊШмНўМСЃЌдђШмНўЙ§ГЬжаЛсЗЂЩњЃКCaSO4ЃЈsЃЉ+![]() CaCO3ЃЈsЃЉ+
CaCO3ЃЈsЃЉ+![]()
вбжЊ298KЪБЃЌKspЃЈCaCO3ЃЉ=2.80ЁС10Љ9ЃЌKspЃЈCaSO4ЃЉ=4.90ЁС10Љ5ЃЌЧѓДЫЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§K_____________ЃЈМЦЫуНсЙћБЃСєШ§ЮЛгааЇЪ§зжЃЉЃЎ
ЁОД№АИЁПCaSO4 MgЃЈOHЃЉ2 ЧтбѕИљгыУОРызгНсКЯЪЙЦНКтЯђгввЦЖЏЃЌМиРызгБфЖр K2CO3 H2SO4 дкЭЌвЛЪБМфK+ЕФНўГіХЈЖШДѓ ЗДгІЫйТЪМгПьЃЌЦНКтЪБШмНўЪБМфЖЬ 1.75ЁС104
ЁОНтЮіЁП
ЃЈ1ЃЉвРОнСїГЬКЭжЦШЁФПЕФЃЌНсКЯЁАДєПѓЁБЃЌдкЫЎжаДцдкЕФЦНКтЗжЮіЃЌМгШыБЅКЭCaЃЈOHЃЉ2ШмвКЖдЦНКтЕФгАЯьЗжЮіХаЖЯЃЛ
ЃЈ2ЃЉвРОнЧтбѕЛЏИЦКЭЦНКтзДЬЌЯТЕФУОРызгНсКЯЩњГЩЧтбѕЛЏУОГСЕэЃЌДйНјЦНКтгввЦЗжЮіЃЛ
ЃЈ3ЃЉЃЉЁАГ§дгЁБЛЗНкжажївЊЪЧГ§ШЅИЦРызгЃЌЕЋВЛФмв§ШыаТЕФдгжЪЃЌЕїНкШмвКPHГЪжаадЃЌГ§ШЅМгШыЕФЬМЫсМиЃЌЕУЕННЯДПОЛЕФСђЫсМиЃЌашвЊМгШыСђЫсЕїНкЃЛ
ЃЈ4ЃЉвРОнЭМЯѓЗжЮіЃЌзнжсвтвхЃЌЧњЯпЕФБфЛЏЃЌДяЕНЦНКташвЊЕФЪБМфЗжЮіХаЖЯЃЛ
ЃЈ5ЃЉвдПЩШмадЬМЫсбЮЮЊШмНўМСЃЌдђШмНўЙ§ГЬжаЛсЗЂЩњЃКCaSO4ЃЈsЃЉ+CO32ЉЃЈaqЃЉCaCO3ЃЈsЃЉ+SO42ЉЃЈaqЃЉЦНКтГЃЪ§ИХФюаДГіМЦЫуЪНЃЌвРОнСђЫсИЦЁЂЬМЫсИЦШмЖШЛ§ГЃЪ§ЕФМЦЫуБэДяЪНЃЌзЊЛЏЙиЯЕжаИЦРызгЯрЭЌМЦЫуЗжЮі
ЃЈ1ЃЉЁАДєПѓЁБЃЌдкЫЎжаДцдкГСЕэШмНтЦНКтЃКK2SO4MgSO42CaSO42H2OЃЈsЃЉ2Ca2++2K++Mg2++4SO42Љ+2H2OЃЌЮЊФмГфЗжРћгУМизЪдДЃЌгУБЅКЭCaЃЈOHЃЉ2ШмвКШмНўдгТБЪЏжЦБИСђЫсМиЃЌЧтбѕИљРызгКЭУОРызгНсКЯЩњГЩЧтбѕЛЏУОГСЕэЃЌЭЌЪБИЦРызгдіЖрЃЌЮіГіСђЫсИЦГСЕэЃЌЫљвдТЫдќжажївЊГЩЗжЮЊCaSO4ЃЌMgЃЈOHЃЉ2ЃЌЙЪД№АИЮЊCaSO4ЃЛMgЃЈOHЃЉ2ЃЛ
ЃЈ2ЃЉCaЃЈOHЃЉ2ШмвКФмШмНтдгТБЪЏНўГіK+ЕФдвђЪЧЧтбѕЛЏИЦЪЧБЅКЭШмвКЃЌМгШыКѓЧтбѕИљРызгКЭУОРызгНсКЯЩњГЩЧтбѕЛЏУОГСЕэЃЌДйНјЦНКтгввЦИЦРызгдіЖрЃЌБЅКЭШмвКжаЮіГіЧтбѕЛЏИЦЃЌдіЖрK+ЃЌЙЪД№АИЮЊЧтбѕИљгыУОРызгНсКЯЪЙЦНКтЯђгввЦЖЏЃЌМиРызгБфЖрЃЛ
ЃЈ3ЃЉЁАГ§дгЁБЛЗНкжївЊЪЧГ§ШЅИЦРызгЃЌвРОнГ§дгддђВЛФмв§ШыаТЕФдгжЪЃЌИљОнжЦШЁЕФФПЕФЪЧжЦБИСђЫсМиЃЌЫљвдМгШыЕФЪдМСвзгкГ§ШЅЃЌВЛв§ШыаТЕФдгжЪЃЌвђДЫМгШыЙ§СПK2CO3Г§ИЦРызгЃЌЙ§ТЫКѓМгШыСђЫсжСжаадЃЌГ§ШЅЬМЫсМиЃЌЙЪД№АИЮЊK2CO3ЃЛH2SO4ЃЛ
ЃЈ4ЃЉЗжЮіВЛЭЌЮТЖШЯТЃЌK+ЕФНўГіХЈЖШгыШмНўЪБМфЕФЙиЯЕЃЌЮТЖШдНИпK+ЕФНўГіХЈЖШдНДѓЃЌШмНўЪБМфдНЖЬЃЌЗДгІЫйТЪдНДѓЃЌДяЕНЦНКтдНПьЃЌЙЪЭМЯѓжаЗжЮіЕУЕНЕФНсТлЮЊЃКЮТЖШдНИпЃЌдкЭЌвЛЪБМфK+ЕФНўГіХЈЖШДѓЃЛЗДгІЫйТЪМгПьЃЌЦНКтЪБШмНўЪБМфЖЬЃЌ
ЙЪД№АИЮЊдкЭЌвЛЪБМфK+ЕФНўГіХЈЖШДѓЃЛЗДгІЫйТЪМгПьЃЌЦНКтЪБШмНўЪБМфЖЬЃЛ
ЃЈ5ЃЉШмНўЙ§ГЬжаЛсЗЂЩњЃКCaSO4ЃЈsЃЉ+CO32ЉЃЈaqЃЉCaCO3ЃЈsЃЉ+SO42ЉЃЈaqЃЉЃЌCaCO3ЃЈsЃЉ=Ca2++CO32ЉЃЛCaSO4ЃЈsЃЉ=Ca2++SO42ЉЃЛвРОнСђЫсИЦЁЂЬМЫсИЦШмЖШЛ§ГЃЪ§ЕФМЦЫуБэДяЪНЃЌзЊЛЏЙиЯЕжаИЦРызгЯрЭЌМЦЫуЃЌЗДгІЕФЦНКтГЃЪ§K=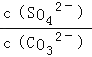 =
=![]() =
=![]() =1.75ЁС104ЃЌЙЪД№АИЮЊ1.75ЁС104ЃЎ
=1.75ЁС104ЃЌЙЪД№АИЮЊ1.75ЁС104ЃЎ