题目内容
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
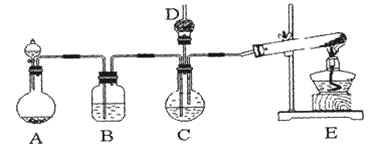
(1)A中制备气体时,所需药品是(选填字母序号)______________;
(2)B中盛有饱和碳酸氢钠溶液,其作用是______________________________;
(3)写出制取氨气的化学方程式__________________________________;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式______________;
(5)检验D出口处是否有氨气逸出的方法是__________________________;
(6)写出制纳米级碳酸钙的化学方程式______________________________。
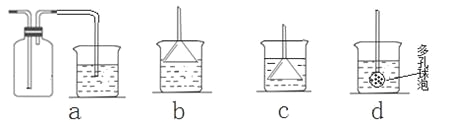
(7)若实验过程中有氨气逸出,应选用下列_____________装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
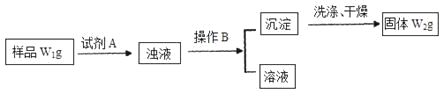
试回答:
(1)所加试剂A的化学式为______________________________________;
(2)B操作方法是_______________________________________________;
(3)样品中氯化铵的质量分数为___________________________________。
【答案】ac 除去CO2中的HCl 2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O NH3 将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。) CaCl2 + H2O + CO2 + 2NH3=CaCO3 + 2NH4Cl b Ca(OH)2或Ba(OH)2或AgNO3和HNO3 过滤
CaCl2+ 2NH3↑+ 2H2O NH3 将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。) CaCl2 + H2O + CO2 + 2NH3=CaCO3 + 2NH4Cl b Ca(OH)2或Ba(OH)2或AgNO3和HNO3 过滤  或
或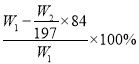 或53.5W2/143.5W1×100%
或53.5W2/143.5W1×100%
【解析】
I.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙,由图及给出的药品可知,A中制备二氧化碳,B中盛有饱和碳酸氢钠溶液,可除去二氧化碳中混有的HCl,E中制备氨气,在C中制备纳米级碳酸钙,结合氨气极易溶于水、氨水显碱性解答;
Ⅱ.氯化铵样品中含有杂质碳酸氢钠,为了测定氯化铵的质量分数,结合实验流程可知利用的是沉淀法,结合原子守恒计算。
Ⅰ.(1)分析题意知,装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,答案为:ac;
(2)浓盐酸易挥发,生成的二氧化碳中含有氯化氢,饱和NaHCO3溶液可除去二氧化碳中的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热,生成氯化钙、氨气和水,方程式为:2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O;
CaCl2+ 2NH3↑+ 2H2O;
(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;
(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,因此检验D出口处是否有氨气逸出的方法为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);
(6)根据原子守恒可知还有氯化铵生成,则制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;
(7)氨气极易溶于水要防止倒吸,答案为:b;
Ⅱ.(1)根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成碳酸钡或碳酸钙沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;氯化铵能与硝酸酸化的硝酸银反应生成氯化银沉淀,根据沉淀的质量求出氯化铵的质量,最后求出氯化铵的质量分数;所以A为Ca(OH)2或Ba(OH)2或AgNO3和HNO3;
(2)操作B为不溶物和溶液分离操作,用过滤的方法;
(3)若试剂为Ca(OH)2溶液,根据碳守恒得关系式:NaHCO3~CaCO3,计算得NaHCO3的质量为84W2/100g,则氯化铵的质量为(W1—84W2/100)g,氯化铵的质量分数为 ,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为
,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为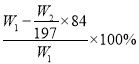 ,若试剂为AgNO3和HNO3,由关系式NH4Cl~AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
,若试剂为AgNO3和HNO3,由关系式NH4Cl~AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。

【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进 Fe2O3的转化,可采取的措施是____(选填序号)
a.用更高效的催化剂 b.粉碎矿石,增大接触面积
c.及时吸收或移出CO2 d.增大反应体系的压强
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.再加入一些铁粉 b.充入一定量CO
c.增大压强 d.升高温度