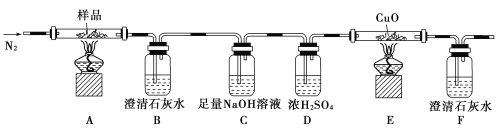
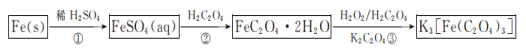【题目】Ⅰ.某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,该滴定实验可使用的指示剂为___,达到滴定终点的现象为___。
(2)样品中氨的质量分数表达式为___。
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为___mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
Ⅱ.已知
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(4)则用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为___加入___调节pH为___(保留两位有效数字),铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
【题目】氨可用于制取氨水、氮肥、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业.
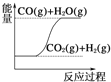
(1)以甲烷为原料可制得合成氨用的氢气,有关反应的能量变化如下图所示:
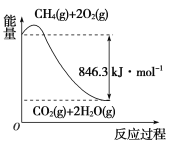
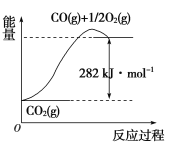
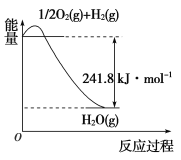
写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式:_______________。
(2)已知N2(g)+3H2(g)![]() 2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
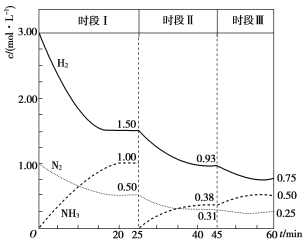
①前20min内v(NH3)=________mol/(L·min),放出的热量为________。
②45min时采取的措施是________;时段III条件下反应的平衡常数为________(保留3位有效数字)。
(3)一定温度下,将不同量的CO2、NH3分别通入某恒容密闭容器中进行下列反应:2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g);△H<0,得到如下数据:
实验组 | 起始量/mol | 平衡时的转化率 | 平衡时气体平均相对分子质量 | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
①a1________a4(填“<”、“=”或“>”);M1________ M2(填“<”、“=”或“>”)。
②若a5>a6,则n1,n2必须满足的关系是________。
(4)室温时将氨通入500mL 0.1mol·L-1盐酸中至pH=6,所得溶液中离子浓度由大到小的顺序是____________________________________________。
(5)氨、空气、KOH溶液可构成燃料电池,反应原理为4NH3+3O2=2N2+6H2O,反应一段时间后,电解质溶液的pH将________(填“增大”“减小”或“不变”)。
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
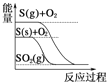
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
浓度/(mol/L)/时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=___mol·L-1·min-1;计算该反应的平衡常数K=__。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是__(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___(填“升高”或“降低”),△H__0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
2CH3OH(g) ![]() CH3OCH3(g)+H
CH3OCH3(g)+H
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=__。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
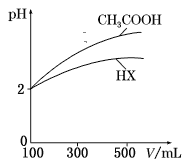
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
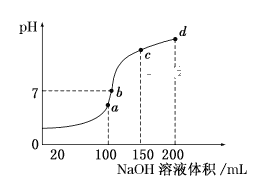
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。