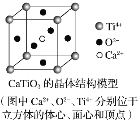
题目内容
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是

A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
【答案】A
【解析】
A.多元弱酸分步电离,以第一步为主,根据H2X![]() H++HX-,c(H+)=
H++HX-,c(H+)=![]() =
=![]() ≈10-3,a近似等于3,故A正确;
≈10-3,a近似等于3,故A正确;
B.点②处恰好生成NaHX,根据电荷守恒c(Na+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)和质子守恒c(H+)+c(H2X)= c(X2-)+c(OH-)得:c(Na+)+2c(H+)+ c(H2X)=3 c(X2-)+ c(HX-)+2c(OH-),故B错误;
C. H2X和NaOH恰好反应生成Na2S,为中和反应的滴定终点,点④处为滴定终点,故C错误;
D.点④处恰好生成Na2X,c(Na+)>2c(X2-)>c(OH-)>c(HX-)>c(H+),故D错误;
答案:A

【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:
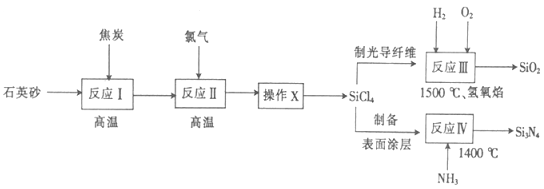
回答下列问题:
(1)反应I的化学方程式为2C+SiO2![]() Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2![]() Si+CO2↑(碳不足)和__________________________________(碳足量)。
Si+CO2↑(碳不足)和__________________________________(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为______________________;PCl3的电子式为________________。
(3)反应IV的化学方程式为SiCl4+4NH3![]() Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。