题目内容
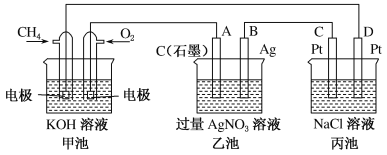
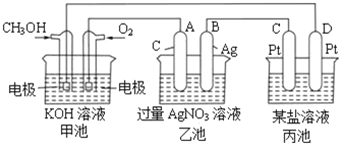
【题目】Ⅰ.如图是一个电化学过程的示意图。
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式______。
(2)乙池中反应的化学方程式为__________________,当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为______L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是______(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。
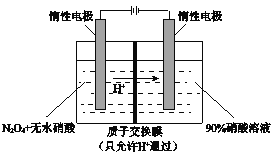
阳极区生成N2O5的电极反应式是___________________________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O4AgNO3+2H2O![]() 4Ag+O2↑+4HNO30.28BN2O4-2e-+2HNO3=2N2O5+2H+
4Ag+O2↑+4HNO30.28BN2O4-2e-+2HNO3=2N2O5+2H+
【解析】
试题Ⅰ.(1)甲醇失去电子,据此书写电极反应式;
(2)根据正负极判断阴阳极,据此书写电解硝酸银溶液的反应式;根据电子得失守恒分析计算和判断;
Ⅱ.阳极发生失去电子的氧化反应。
解析:Ⅰ.(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动。该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解AgNO3溶液,电解方程式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;当乙池中B(Ag)极质量增加5.4 g,得到的电子的物质的量为
4Ag+O2↑+4HNO3;当乙池中B(Ag)极质量增加5.4 g,得到的电子的物质的量为![]() mol=0.05 mol,由电子守恒可知,生成氧气的物质的量为
mol=0.05 mol,由电子守恒可知,生成氧气的物质的量为![]() mol=0.0125 mol,在标准状况下的体积为0.0125 mol×22.4 L/mol=0.28 L。此时丙池中某电极析出1.6 g某金属,设该金属为+2价金属,则M=1.6 g÷(0.5 mol/2)=64 g/mol,则该金属为Cu,如果是+1价,则相对原子质量=1.6÷0.05=32答案选B。
mol=0.0125 mol,在标准状况下的体积为0.0125 mol×22.4 L/mol=0.28 L。此时丙池中某电极析出1.6 g某金属,设该金属为+2价金属,则M=1.6 g÷(0.5 mol/2)=64 g/mol,则该金属为Cu,如果是+1价,则相对原子质量=1.6÷0.05=32答案选B。
Ⅱ.阳极发生失去电子的氧化反应,NO2在阳极失去电子结合硝酸根转化为N2O5,电极反应式为N2O4-2e-+2NO3-=2N2O5。

【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
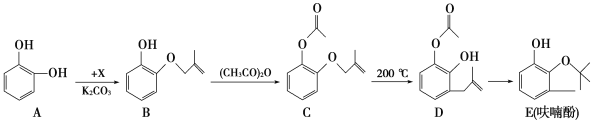
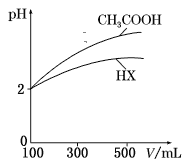
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
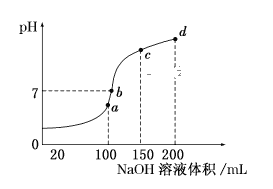
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。