题目内容
【题目】氨可用于制取氨水、氮肥、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业.
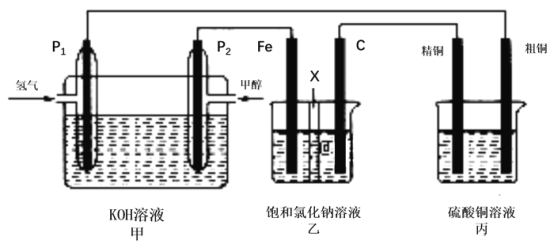
(1)以甲烷为原料可制得合成氨用的氢气,有关反应的能量变化如下图所示:



写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式:_______________。
(2)已知N2(g)+3H2(g)![]() 2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:

①前20min内v(NH3)=________mol/(L·min),放出的热量为________。
②45min时采取的措施是________;时段III条件下反应的平衡常数为________(保留3位有效数字)。
(3)一定温度下,将不同量的CO2、NH3分别通入某恒容密闭容器中进行下列反应:2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g);△H<0,得到如下数据:
实验组 | 起始量/mol | 平衡时的转化率 | 平衡时气体平均相对分子质量 | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
①a1________a4(填“<”、“=”或“>”);M1________ M2(填“<”、“=”或“>”)。
②若a5>a6,则n1,n2必须满足的关系是________。
(4)室温时将氨通入500mL 0.1mol·L-1盐酸中至pH=6,所得溶液中离子浓度由大到小的顺序是____________________________________________。
(5)氨、空气、KOH溶液可构成燃料电池,反应原理为4NH3+3O2=2N2+6H2O,反应一段时间后,电解质溶液的pH将________(填“增大”“减小”或“不变”)。
【答案】CH4(g)+H2O(g)=CO(g)+3H2(g);△H= +161.1kJ·mol-1 0.05 94.4 kJ 降温 2.37 < > n1<2n2 c(Cl-)>c(NH4+)>c(H+)>c(OH-) 减小
【解析】
(1)由图示得到题给图像已知热化学方程式,由盖斯定律计算可得;
(2)①由图给数据和反应速率公式计算;由生成氨气的物质的量和热化学方程式计算;
②该反应是一个气体体积减小的放热反应,降低温度,平衡向正反应方向移动;依据图给数据和平衡常数公式计算;
(3)当投料比等于化学计量数之比时,反应物转化率相等,由此分析;
(4)溶液呈酸性,溶液中c(H+)>c(OH-),由溶液中存在的电荷守恒关系c(NH4+)+c(H+)=c(OH-)+ c(Cl-)可知,溶液中c(Cl-)>c(NH4+);
(5)由于电解质溶液为碱性,放电时生成水,相当于稀释了KOH溶液。
(1)由图可知,①②③的反应物能量都高于生成物能量,所以三个反应都是放热反应;已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1= -846.3 kJ·mol-1,②CO(g)+![]() O2(g)=CO2(g);△H2= -282 kJ·mol-1,③
O2(g)=CO2(g);△H2= -282 kJ·mol-1,③![]() O2(g)+H2(g)=H2O(g);△H3= -241.8 kJ·mol-1,根据盖斯定律①-②-③×3可以得到的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH=△H1-△H2-3△H3=(-846.3kJ·mol-1)-(-282kJ·mol-1)-3×(-241.8kJ·mol-1)= +161.1kJ·mol-1,故答案为CH4(g)+H2O(g)=CO(g)+3H2(g);△H= +161.1kJ·mol-1;
O2(g)+H2(g)=H2O(g);△H3= -241.8 kJ·mol-1,根据盖斯定律①-②-③×3可以得到的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH=△H1-△H2-3△H3=(-846.3kJ·mol-1)-(-282kJ·mol-1)-3×(-241.8kJ·mol-1)= +161.1kJ·mol-1,故答案为CH4(g)+H2O(g)=CO(g)+3H2(g);△H= +161.1kJ·mol-1;
(2)①由图可知,20min时生成c(NH3)=1mol/L,则v(NH3)=![]() =0.05mol/(L·min);反应生成n(NH3)=1mol/L×2L=2mol,则放出的热量为94.4kJ,故答案为0.05;94.4 kJ;
=0.05mol/(L·min);反应生成n(NH3)=1mol/L×2L=2mol,则放出的热量为94.4kJ,故答案为0.05;94.4 kJ;
②由图可知,45min瞬间时,各物质浓度不变,45min后氨的浓度增大,氮气和氢气浓度减小,说明平衡向正反应方向移动,该反应是一个气体体积减小的放热反应,则所采取的措施只能是降温;时段Ⅲ条件下反应达到平衡时,氨气浓度为0.50mol/L,氢气浓度为0.75 mol/L,氮气浓度为0.25mol/L,则化学平衡常数K=![]() =
=![]() =2.37,故答案为降温;2.37;
=2.37,故答案为降温;2.37;
(3)①当投料比等于化学计量数之比时,反应物转化率相等,实验组1和实验组2投料比等于化学计量数之比,则a1=a2,a3=a4,由实验组1和实验组2投料比可知,恒容条件下实验组2相当于实验组1的加压,该反应为气体体积减小的反应,增大压强,平衡向化学计量数减小的方向移动,反应物转化率增大,a1<a4;反应前气体平均相对分子质量为(![]() ×17+
×17+![]() ×44)=26,若反应完全进行所得气体的相对分子质量为18,加压,平衡正向移动,则气体平均相对分子质量减小,M1>M2,故答案为<;>;
×44)=26,若反应完全进行所得气体的相对分子质量为18,加压,平衡正向移动,则气体平均相对分子质量减小,M1>M2,故答案为<;>;
②当投料比等于化学计量数之比时,反应物转化率相等,若a5>a6,则n1,n2必须满足的关系是n1<2n2,故答案为n1<2n2;
(4)室温时将氨通入500mL 0.1mol·L-1盐酸中至pH=6,溶液呈酸性,溶液中c(H+)>c(OH-),由溶液中存在的电荷守恒关系c(NH4+)+c(H+)=c(OH-)+ c(Cl-)可知,溶液中c(Cl-) >c(NH4+),
则所得溶液中离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>cH+)>c(OH-),故答案为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)由于电解质溶液为碱性,放电时生成水,相当于稀释了KOH溶液,故放电一段时间后溶液pH减小,故答案为减小。

 阅读快车系列答案
阅读快车系列答案【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
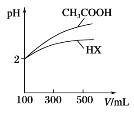
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。