题目内容
【题目】下列有关电解质溶液的说法中正确的是
A.pH均为5的HCl和NH4Cl溶液中,两溶液中水的电离程度相同
B.常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-)
C.等体积、等浓度的NaX溶液和弱酸HX溶液混合后的溶液中一定存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
【答案】B
【解析】
A项、HCl电离出氢离子抑制水的电离,NH4Cl在溶液中水解促进水的电离,两溶液中水的电离程度不同,故A错误;
B项、常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,,则溶液中c(H+)=c(OH-),溶液中存在电荷守恒关系c(Na+)+c(H+)=c(OH-) + c(A-),则溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-),故B正确;
C项、若等体积、等浓度的NaX溶液和弱酸HX溶液混合后溶液呈酸性,存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),若溶液呈碱性,存在: c(HX)>c(Na+)> c(X-) > c(OH-)> c(H+),故C错误;
D项、向浅绿色的Fe(NO3)2溶液中加入盐酸,NO3-在酸性环境下氧化Fe2+生成Fe3+,溶液变为黄色,故D错误;
故选B。

【题目】Ⅰ.某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,该滴定实验可使用的指示剂为___,达到滴定终点的现象为___。
(2)样品中氨的质量分数表达式为___。
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为___mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
Ⅱ.已知
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(4)则用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为___加入___调节pH为___(保留两位有效数字),铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
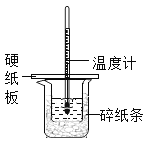
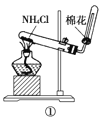
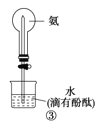
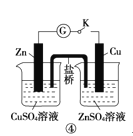
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D