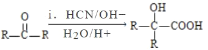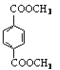题目内容
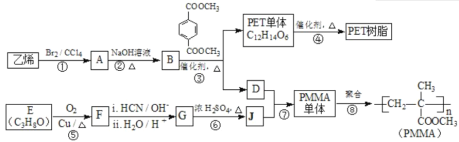
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷.以铁屑为原料的制备流程如下:
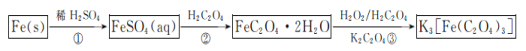
回答下列问题:
(1)流程中“①”加入的稀硫酸需稍过量,其目的是________________;若要从所得溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是________(按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(2)流程中“②”需过滤分离,则加入H2C2O4发生反应的化学方程式为__________。
(3)流程中“③”需控制溶液温度不高于40 ℃,理由是________________;该步反应的化学方程式为________________________;得到K3[Fe(C2O4)3]溶液后,加入乙醇,然后进行过滤,加入乙醇的理由是________________________________。
(4)所得晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。滴定过程中发现,开始时滴入1滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后,紫红色很快褪去,原因可能是______。
(5)三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验:
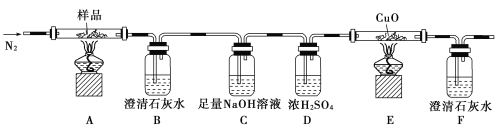
检查装置气密性后,先通一段时间的N2,其目的是____________________;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是______________。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)
(乙)![]() 酸性KMnO4溶液V mL
酸性KMnO4溶液V mL
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是________。
【答案】抑制Fe2+的水解 bcae FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4 防止H2O2分解 2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O 三草酸合铁酸钾在乙醇中的溶解度小,有利于析出三草酸合铁酸钾晶体 生成的Mn2+起催化作用 排出装置内空气,防止干扰实验结果 CO2、CO 甲 ![]()
【解析】
由题给流程可知,铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;反应生成的硫酸亚铁溶液与草酸反应生成FeC2O42H2O沉淀和硫酸,反应的化学方程式为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4;向FeC2O42H2O沉淀中加入草酸钾、双氧水,发生氧化还原反应生成K3[Fe(C2O4)3]3H2O。
(1)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解;绿矾晶体含有结晶水,则从硫酸亚铁溶液得到绿矾晶体的操作应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为防止亚铁离子水解;bcae;
(2)流程中“②”需过滤分离,说明FeC2O42H2O难溶于水,则硫酸亚铁溶液与草酸反应生成FeC2O42H2O沉淀和硫酸,反应的化学方程式为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4,故答案为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4;
(3)双氧水受热易分解,则控制溶液温度不高于40 ℃的目的是防止H2O2分解;向FeC2O42H2O沉淀中加入草酸钾、双氧水,发生氧化还原反应生成K3[Fe(C2O4)3]3H2O,反应的化学方程式为2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O;由题意可知,三草酸合铁酸钾难溶于乙醇,加入乙醇可降低其溶解度,有利于三草酸合铁酸钾晶体析出,故答案为防止H2O2分解;2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O;
(4)由开始时滴入1滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后,紫红色很快褪去,说明反应生成的硫酸锰做反应的催化剂,加快了反应速率,故答案为生成的Mn2+起催化作用;三草酸合铁酸钾在乙醇中的溶解度小,有利于析出三草酸合铁酸钾晶体;
(5)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体一氧化碳的产生,故答案为排除装置中的空气,防止干扰实验结果; CO2、CO;
②乙方案中先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成;由甲方案可知最终生成bg氧化铁,由铁原子个数守恒可知铁样品中铁元素的质量为![]() g,则含铁样品中铁元素的含量为
g,则含铁样品中铁元素的含量为![]() ,故答案为甲;
,故答案为甲;![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
浓度/(mol/L)/时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=___mol·L-1·min-1;计算该反应的平衡常数K=__。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是__(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___(填“升高”或“降低”),△H__0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
2CH3OH(g) ![]() CH3OCH3(g)+H
CH3OCH3(g)+H
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=__。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)