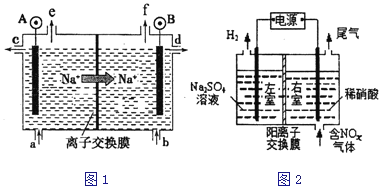
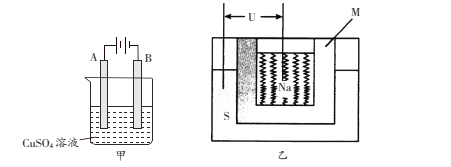
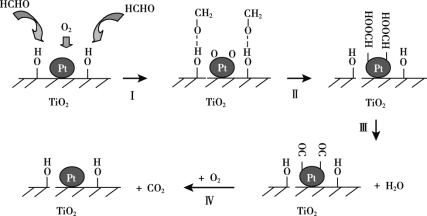
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
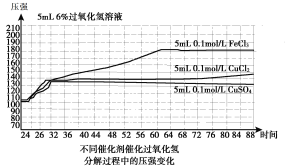
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响