题目内容
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
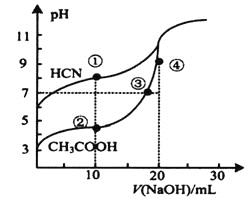
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
【答案】AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=c(Ag+)
Ag+(aq)+Cl-(aq) Ksp=c(Ag+)![]() c(Cl-) 减少 ③ c(Na+)>c(CN-)>c(OH-)>c(H+) HCO3-+H2O
c(Cl-) 减少 ③ c(Na+)>c(CN-)>c(OH-)>c(H+) HCO3-+H2O![]() H2CO3-+ OH-; 2.5
H2CO3-+ OH-; 2.5![]() 10-8 0.02 CN-+CO2+H2O=HCN+HCO3-
10-8 0.02 CN-+CO2+H2O=HCN+HCO3-
【解析】
(1)由对应酸的电离平衡常数酸性CH3COOH> H2CO3 > HCN > HCO3 -,酸性越弱对应盐的水解程度越大,溶液的碱性最强,判断则溶液碱性的强弱;
(2)根据NaCN溶液中CN-离子水解,溶液显碱性判断溶液中离子浓度的大小;
(3)根据水解常数为Kh=![]() 关系进行计算。
关系进行计算。
(1)AgCl属于难溶性强电解质,溶于水形成饱和溶液存在着AgCl沉淀溶解平衡,其沉淀溶解平衡方程式为AgCl(s)![]() Ag+(aq)+Cl-(aq); 沉淀溶解平衡常数Ksp=c(Ag+)
Ag+(aq)+Cl-(aq); 沉淀溶解平衡常数Ksp=c(Ag+)![]() c(Cl-);答案:AgCl(s)
c(Cl-);答案:AgCl(s)![]() Ag+(aq)+Cl-(aq); Ksp=c(Ag+)
Ag+(aq)+Cl-(aq); Ksp=c(Ag+)![]() c(Cl-);
c(Cl-);
(2)温度不变,Ksp不变,向该饱和AgCl溶液中加入NaCl固体,c(Cl-)增大,根据Ksp=c(Ag+)![]() c(Cl-),则C(Ag+)减少;答案:减少;
c(Cl-),则C(Ag+)减少;答案:减少;
(二)(1)由对应酸的电离平衡常数分析可知:酸性CH3COOH> H2CO3 > HCN > HCO3 -,酸性越弱对应盐的水解程度越大,溶液的碱性最强,则溶液中碱性②NaOH溶液>①NaCN溶液>④NaHCO3溶液>③CH3COONa溶液,这4种溶液pH最小的是: ③CH3COONa溶液;答案:③;
(2) NaCN溶液中CN-离子水解,溶液显碱性,溶液中离子浓度大小为:c(Na+)> c(CN-)> c(OH- )> c(H+);答案:c(Na+)> c(CN-)> c(OH- )> c(H+);
(3)④为NaHCO3溶液,弱根离子为HCO3-,发生水解反应的方程式为HCO3-+H2O![]() H2CO3-+ OH-;答案:HCO3-+H2O
H2CO3-+ OH-;答案:HCO3-+H2O![]() H2CO3-+ OH-;
H2CO3-+ OH-;
④NaHCO3溶液中碳酸氢根离子水解, HCO3-+H2O![]() H2CO3-+ OH-,水解常数为Kh= [c(OH-)
H2CO3-+ OH-,水解常数为Kh= [c(OH-)![]() c(H2CO3) ]/ c( HCO3- )=
c(H2CO3) ]/ c( HCO3- )=![]() =
=![]() =2.5
=2.5![]() 10-8;故答案为: HCO3-+H2O
10-8;故答案为: HCO3-+H2O![]() H2CO3-+ OH-;2.5
H2CO3-+ OH-;2.5![]() 10-8;
10-8;
(4)25°C时,测得HCN和NaCN的混合溶 液的pH= 11,![]() =
=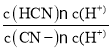 =
=![]() =
=![]() =0.02; 碳酸的一级电离常数大于HCN的电离常数,二级电离常数小于HCN的电离常数,故碳酸的酸性强于HCN,为碳酸氢根的酸性溶于HCN, 故向NaCN溶液中通入少量CO2,反应生成HCN与NaHCO3,该反应离子方程式为: CN-+CO2+H2O=HCN+HCO3-故答案为: 0.02 ; CN-+CO2+H2O=HCN+HCO3-。
=0.02; 碳酸的一级电离常数大于HCN的电离常数,二级电离常数小于HCN的电离常数,故碳酸的酸性强于HCN,为碳酸氢根的酸性溶于HCN, 故向NaCN溶液中通入少量CO2,反应生成HCN与NaHCO3,该反应离子方程式为: CN-+CO2+H2O=HCN+HCO3-故答案为: 0.02 ; CN-+CO2+H2O=HCN+HCO3-。

【题目】用铝土矿![]() 主要成分为
主要成分为![]() ,含
,含![]() 杂质
杂质![]() 为原料冶炼铝的工艺流程如下:下列叙述正确的是
为原料冶炼铝的工艺流程如下:下列叙述正确的是![]()
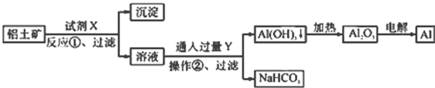
A.试剂X可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.操作②中发生的化学方程式为![]()
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
【题目】氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)。
4NO(g) + 6H2O(g)。
(1)升高温度,反应的平衡常数K值减小,则该反应的焓变△H_____0(填“>”、“<”或“=”)。
(2)下列能说明上述反应已达到平衡状态__________(填序号)
A.NH3的浓度不随时间变化
B.v正(O2)= v逆(NO)
C.体系的分子总数不再变化
D.单位时间内消耗4molNH3的同时生成6molH2O
(3)若其他条件不变,下列关系图错误的是______(选填序号)。
A.  B.
B.  C.
C.  D.
D. 
(4)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2 min | 3.2 | 0.8 | 1.2 | |
第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①上表中空白处应填的数字为______。
②反应在第 2 min 到第 4 min 时,反应速率v(O2)=___________。
③反应在第 2 min 时改变了条件,改变的条件可能______;该条件下,反应的平衡常数K=_______(只写计算结果,不标单位)。
【题目】环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
![]()
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_______________。
②蒸馏不能分离环己酮和水的原因是_______________。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需__________。
③在上述操作c中,加入NaCl 固体的作用是____________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有___种不同化学环境的氢原子。