��Ŀ����
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á�
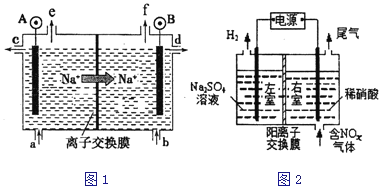
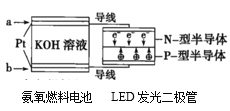
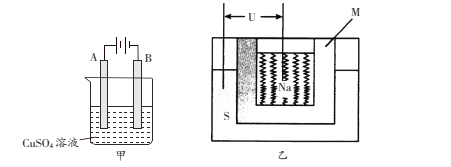
��1�����ʳ��ˮ���ȼҵ�Ļ�����Ŀǰ�Ƚ��Ƚ��ķ����������ӽ���Ĥ�������ʾ��ͼ��ͼ1��ʾ��ͼ�е������ӽ���Ĥֻ����������ͨ������ش��������⣺
�ٵ���ʵ����_______����_______�ܵ�ת����
��ͼ��A��Ҫ���ӵ�Դ��__________������������������������
�۵���ܷ�Ӧ�Ļ�ѧ����ʽ��______________________��
��2����ⷨ��������������������ɻ������ᣬ���нϸߵĻ���Ч��;���Ч�档ʵ����ģ���ⷨ����NOx��װ����ͼ2��ʾ��ͼ�е缫��Ϊʯī�缫��������NO2�������ģ���ⷨ����ʵ�飬д�����ʱNO2�����ĵ缫��Ӧ_______________________��
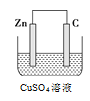
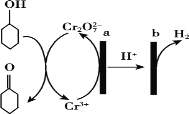
��3����ʵ�������У����������ı����϶�ͭ��ֹ������ʴ��װ��ʾ��ͼ���¼�ͼ��
�ٵ��ʱ���Ƽ����Դ��____�����ӣ�
��B�缫�ϵĵ缫��Ӧ��________________��
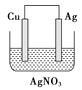
����ͼ��һ��������ܵ�صĽṹʾ��ͼ��M��Na2O��Al2O3�Ƶã��������ǵ����Ĥ���õ�ط�ӦΪ2Na+xS=Na2Sx���øõ������Դ��������������ͭʱ������Ƴ������缫��������ʼ��ͬ�������ɺ�ȡ��ϴ������ɡ�����������������Ϊ25.6g���������ϸõ�ظ������ĵ�����Ϊ___________g��
���𰸡��� ��ѧ �� 2Cl-+2H2O![]() Cl2��+H2��+2OH- NO2-e-+H2O=NO3-+2H+�� ���� Cu2++2e-=Cu; 9.2g
Cl2��+H2��+2OH- NO2-e-+H2O=NO3-+2H+�� ���� Cu2++2e-=Cu; 9.2g
��������
��1�����ݵ������������������ƶ������жϵ�ص���������
��2���������Ҳ�������������ԭ��Ӧ���������жϳ�����Ϊ�����ң�����Ϊ�����ң�������ɵ缫��Ӧʽ����д��
��3������������·�е����غ���м��㸺�������Ƶ�������
��1���ٵ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ�ã����Դ𰸣��磻��ѧ��
���ɵ��ʳ��ˮװ��ͼ��֪�������������ұߣ��������AΪ����������A��Ҫ���ӵ�Դ���������ʴ�Ϊ:��;
���ɵ��ʳ��ˮװ��ͼ��֪�������������ұߣ������AΪ�������ұ�BΪ����������Ȼ�����Һ���ܷ�Ӧ���ӷ���ʽΪ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
��2���ٸ���ͼ֪�����ʱ�������е缫�������ӷŵ�����������������Ϊ������,����Ϊ
������,������ͨ����ǵ���������ɵ����ᣬ���������ϵ�������ʧ���Ӻ�ˮ��������,�缫��ӦʽΪ:NO2-e-+H2O=NO3-+2H+�ʴ�Ϊ: NO2-e-+H2O=NO3-+2H+��
��3�����������ı����ͭ���Ʋ����ͭ��������������A��Ӧ�Ľ���������ͭ���Ƽ������������ʶƼ���������Դ�ĸ��������Դ𰸣�������
���������Ϸŵ���ǵ������Һ�е�ͭ���ӣ��õ��ӷ�����ԭ��Ӧ���䷴Ӧ�ĵ缫ʽΪ:Cu2++2e-=Cu;�𰸣�Cu2++2e-=Cu;
��ԭ����ܷ�ӦΪ��2Na+xS=Na2Sx�У����ʱ���Ʋ����������Ƽ�������������������ͭʧ���ӷ���������Ӧ���缫��ӦʽΪCu-2e-=Cu2+��������ͭ���ӵõ��ӷ�����ԭ��Ӧ��������ӦʽΪCu2++2e-=Cu;��ƺ������缫��������������ܽ�������������������֮�ͣ������ǰ����ͭ���缫��������ͬ�������ɺ�����ȡ��ϴ������ɡ�����������������Ϊ25.6g , ���������ܽ�ͭ������Ϊ12.8g������ͭ�����ʵ���Ϊ0.2mol��ת�Ƶĵ���Ϊ0.4mol����������Ƴصĵ缫�ĵ��ӵ����ʵ���Ϊ0.4mol����������Ƴصĵ��ӵ���������ԭ������������ĵ��ӵ�����ͬ����ԭ��ظ����ϱ����ĵ������ʵ�������ת�Ƶĵ��ӵ����ʵ���������Ҫת��0.4mol���ӣ���Ҫ����0.4mol Na��������Ϊ0.4mol ![]() 23g/mol=9.2g���𰸣�9.2g��
23g/mol=9.2g���𰸣�9.2g��