题目内容
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
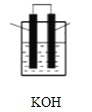
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
【答案】CH2=CH2 CH2=CH2+Br2![]() CH2BrCH2Br 正四面体结构 CH4+10OH--8e-= CO32-+7H2O 2O2+4H2O+8e-=8OH- CH3COOH
CH2BrCH2Br 正四面体结构 CH4+10OH--8e-= CO32-+7H2O 2O2+4H2O+8e-=8OH- CH3COOH![]() CH3COO- +H+ 小于 碱 c(Na)=c(CH3COO-)+c(CH3COOH)
CH3COO- +H+ 小于 碱 c(Na)=c(CH3COO-)+c(CH3COOH)
【解析】
(1)根据有机物的用途和结构判断有机物的名称,进行有机物的性质;
(2)根据一元强酸和一元弱酸的稀释特点进行判断稀释后的pH大小。
(3)根据原子守恒规律书写相应的等量关系式。
(1)有机物A的产量是衡量一个国家石油化工水平的标志;且比例模型为:![]() ,所以有机物为乙烯,其结构简式为CH2=CH2,它与溴水发生加成反应的化学方程式为CH2=CH2+Br2
,所以有机物为乙烯,其结构简式为CH2=CH2,它与溴水发生加成反应的化学方程式为CH2=CH2+Br2![]() CH2BrCH2Br;答案:CH2=CH2;CH2=CH2+Br2
CH2BrCH2Br;答案:CH2=CH2;CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
(2)有机物B为天然气的主要成分,其比例模型为:![]() ,所以B为甲烷,其空间构型为正四面体结构,将甲烷与氧气分别通入如图装置发生反应为CH4+2O2+2KOH=K2CO3+3H2O
,所以B为甲烷,其空间构型为正四面体结构,将甲烷与氧气分别通入如图装置发生反应为CH4+2O2+2KOH=K2CO3+3H2O
构成燃料电池,该电池的负极发生氧化反应,其反应式为CH4+10OH--8e-= CO32-+7H2O ;正极反应为2O2+4H2O+8e-=8OH-;答案:正四面体结构;CH4+10OH--8e-= CO32-+7H2O;2O2+4H2O+8e-=8OH-;
(3)有机物D的分子式为C2H4O2,其水溶液显酸性,是家庭常用调味剂,则D为醋酸,是弱酸,所以在水溶液中的电离方程式为CH3COOH![]() CH3COO- +H+。将pH=3的CH3COOH溶液加水稀释10倍,因为CH3COOH为弱酸,稀释会促进电离,所以得到的溶液的pH小于4,0.1molCH3COOH与等量的NaOH溶液恰好完全反应生成CH3COONa,为强碱弱酸盐,水解后溶液显碱性,该溶液中存在的电荷守恒关系式为c(Na)=c(CH3COO-)+c(CH3COOH);答案:CH3COOH
CH3COO- +H+。将pH=3的CH3COOH溶液加水稀释10倍,因为CH3COOH为弱酸,稀释会促进电离,所以得到的溶液的pH小于4,0.1molCH3COOH与等量的NaOH溶液恰好完全反应生成CH3COONa,为强碱弱酸盐,水解后溶液显碱性,该溶液中存在的电荷守恒关系式为c(Na)=c(CH3COO-)+c(CH3COOH);答案:CH3COOH![]() CH3COO- +H+;小于;碱;c(Na+)=c(CH3COO-)+c(CH3COOH)。
CH3COO- +H+;小于;碱;c(Na+)=c(CH3COO-)+c(CH3COOH)。

 名校课堂系列答案
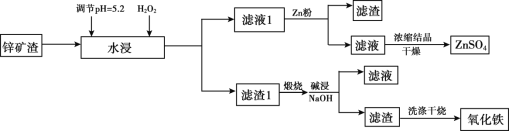
名校课堂系列答案【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
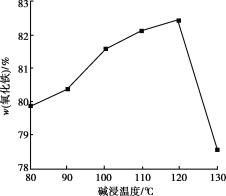
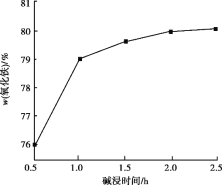
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
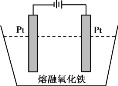
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
【题目】室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
实验 | 操作 | 实验现象 |
Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2)
| 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
Ⅱ |
4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
Ⅲ |
| 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是________,产生原因是_________(用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
实验 | 操作 | 实验现象 |
Ⅳ |
| 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______。残余固体加入浓硝酸时,反应的化学方程式是________。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜(Cu2(OH)2SO4)是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是(Cu2(OH)2SO4);
ii.是Cu(OH)2和(Cu2(OH)2SO4)的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________有关。